
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Скорость химических реакций. Скорость химических реакций
|
|
ХИМИЧЕСКАЯ КИНЕТИКА
Скорость химических реакций
Раздел химии, изучающий скорости и механизм химических реакций, называется химической кинетикой.
Основная величина в химической кинетике – скорость реакции. Химические реакции могут протекать с различной скоростью: очень медленно или быстро (взрыв).
Скорость реакции - это изменения количества реагирующего вещества в единицу времени в единице реакционного пространства (объёма или площади). Это определение справедливо как для гомогенных (реагирующие вещества находятся в одном агрегатном состоянии), так и для гетерогенных процессов (реагирующие вещества находятся в разных агрегатных состояниях). В первом случае реакционным пространством является объём реакционного сосуда, находящегося при температуре опыта, а во втором – поверхность, на которой протекает реакция.
Скорость химической реакции зависит от природы реагирующих веществ, концентрации, температуры, давления, присутствия катализаторов, а в случае гетерогенных превращений – и от ряда других условий (состояние поверхности раздела фаз и т.д.)
Различают среднюю и мгновенную скорости реакции.
Средняя скорость реакции ` V равна:
`V = 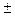
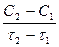 =
= 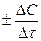 , (1)
, (1)
где С 1 – концентрация вещества в начальный момент времени t1; С 2 – концентрация вещества в конечный момент времени t2. Знак (-) относится к концентрации исходного вещества, а знак (+) – к концентрации продукта.
Скорость реакции в данный момент времени, иначе мгновенная скорость реакции V, равна:
V = 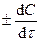 , (2)
, (2)
где d С – дифференциально-малое изменение концентрации за дифферен-циально-малый промежуток времени dt.
Из определения скорости реакции следует, что скорость гомогенной реакции имеет единицы измерения 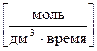 , а гетерогенной -
, а гетерогенной -  .
.
|
|
