
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Z- общее число соударений в единице объема за единицу времени.
|
|
k = ko × eEa/RT = Z× eSa/R × eEa/RT
u = kCa A× CbB = Z× eSa/R × eEa/RT × Ca A× CbB

▒ строят график зависимости в координатах (lg k, 1/T).
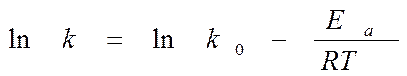
или 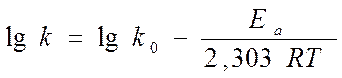
 |
lg k
lg k0 tg a= 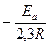
a
1/T
Уравнение Аррениуса в дифференциальной форме:
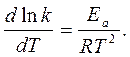

 т.к. Ea /(RT2) > 0 Þ с температуры Þ k
т.к. Ea /(RT2) > 0 Þ с температуры Þ k
k реакции с большей Еа возрастает с температурой сильнее.
Зная k при T1 и T2 Þ рассчитывают Еа.
Интегрируем от T1 до T2 Þ
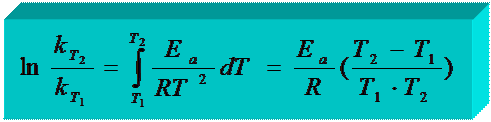
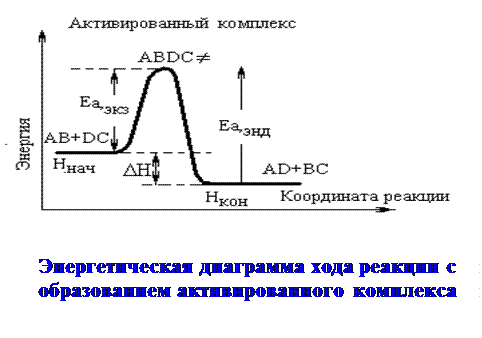
Связь энергии активации с DrH
Пусть протекает равновесная реакция:
АВ + ДС Û АД + ВС
● для прямой реакции:
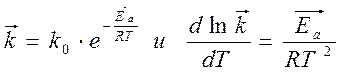
● для обратной реакции:

Вычитая из первого уравнения второе, получим:
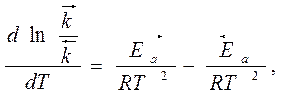
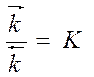 - выражение закона действия масс
- выражение закона действия масс
К – константа равновесия
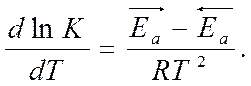
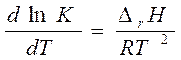 - изобара Вант-Гоффа
- изобара Вант-Гоффа
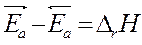 Þ связь термодинамических и кинетических параметров
Þ связь термодинамических и кинетических параметров
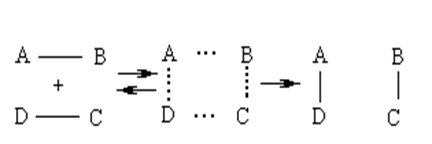 |
Исходные активированный продукты
|
|