
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулы комплекс реакции
|
|
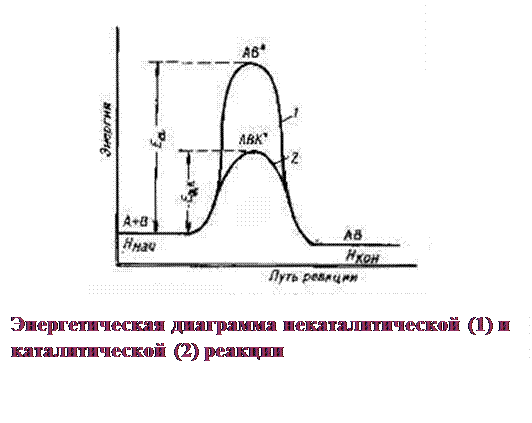
Для образования активированного комплекса необходима энергия Е а:
|
Если Δ rHпрямой реакции > 0 Þ 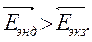 Þ
Þ
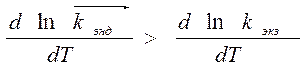
 Þ k эндотерм. с температурой быстрее k экзотерм реакции.
Þ k эндотерм. с температурой быстрее k экзотерм реакции.


Положительный катализ – процесс, ускоряющий реакцию
Отрицательный катализ – процесс, замедляющий реакцию
Kt – ингибиторы (Сl- - ингибитор коррозии)
Антидетонатор Pb(C2H5)4 – замедляет взрывную реакцию топлива
Автокатализ – kt - один из продуктов реакции
FeO + H2 = Fe + H2O Fe - kt
 |
 H2O2 HI-kt H2O + 1/2O2 (H+, OH- -самые активные kt)
H2O2 HI-kt H2O + 1/2O2 (H+, OH- -самые активные kt)

 H2O2 Pt-kt H2O + 1/2O2
H2O2 Pt-kt H2O + 1/2O2
 |
Ферменты являются полимерами (белками) или комплексами полимеров с низкомолекулярными соединениями. Размеры их превышают размеры ионов и молекул в растворах, поэтому ферменты иногда называют микрогетерогенными катализаторами.
Механизм их действия включает образование комплекса активный центр фермента - реагент по типу «замок-ключ».
 |
Особенности kt:
■ kt – участвует в образовании промежуточных нестойких соединений, а в конце выделяется в химически неизменном виде.
■ S(ЕI а + EII а) промежуточных стадий < Е а неkt реакции
 k =Z× e-Ea/RT× eSa/R Þ скорость, если а) Е а
k =Z× e-Ea/RT× eSa/R Þ скорость, если а) Е а
б) Sа- промежуточное соединение- более «рыхлое»- менее упорядоченное- значит более активное.
■ небольшие количества kt - резко ускоряют процесс
 ■ избирательность kt: Al2O3 С2Н4 + Н2О
■ избирательность kt: Al2O3 С2Н4 + Н2О

 С2Н5ОН H3PO4 С2Н5ОС2Н5+ Н2О
С2Н5ОН H3PO4 С2Н5ОС2Н5+ Н2О
MgO СН3СНО + Н2
■ kt – не изменяют DrН и DrG: DrG 0неkt = DrG 0kt
DrG0 = - RTlnKp Þ не влияет на равновесие, только ускоряет его достижение, т.к. в одинаковое число раз изменяет как J прямой р-ции так и J обр.р-ции (К =kпрям /kобр)
Гомогенный катализ:
1. скорость прямо пропорционально зависит от конц.kt;
2. дешевые, доступные;
3. остаются в реакционной среде – надо выделять – плохо
Гетерогенный катализ
◘ Действие kt зависит от способа получения kt:

 акт Cu(NO3)2 to Cu + 2NO2 + O2
акт Cu(NO3)2 to Cu + 2NO2 + O2
 Cu-kt
Cu-kt
 неакт. Cu(NO3)2 электролиз Cu + O2 +HNO3
неакт. Cu(NO3)2 электролиз Cu + O2 +HNO3
 ◘ присутствия других веществ: активаторы - активность kt
◘ присутствия других веществ: активаторы - активность kt
K2O, Al2O3 – для Fe – kt: N2 + 3H2 = 2NH3
 каталит.яды - активность kt
каталит.яды - активность kt
H2S, C2H2, O2 – для Pt-kt: 2SO2 + O2 = 2SO3
◘ уменьшение поверхности kt – надо чистить Þ удорожание

1. Задача. За 1 с в единице реакционного пространства образуется по трем реакциям 66 г СО2, 68 г Н2S и 51 г NН3. Скорость образования какого из веществ больше?
Решение. Найдем количество вещества (ν) в молях каждого из продуктов реакции
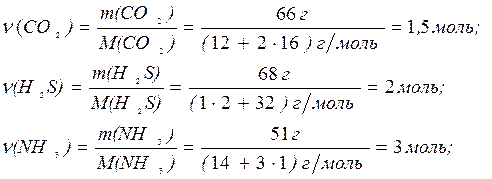 |
|
|