
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи с использованием закона действия масс.
|
|
Перед решением задач следует уяснить следующее
1 При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс.
Пример 1 – Написать выражения закона действия масс для реакций:
а) 2NО(Г) + O2(Г) = 2NO2(Г);
б) CaCO3(K) = CaO(K) + CO2(Г).
Решение
а) v = k[NO]2[O2];
б) поскольку карбонат кальция – твердое вещество, концентрация которого не изменяется в ходе реакции, искомое выражение будет иметь вид: v = k, т. е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 2 – Во сколько раз изменится скорость прямой химической реакции, протекающей в системе 2А(Г) + В(Г) = С(Г), при:
а) увеличении объёма в 3 раза;
б) увеличении давления в 2 раза.
Решение
Закон действия масс для данной конкретной реакции имеет вид:
v = k[А]2[B].
а) при увеличении объёма в три раза давление уменьшили в такое же число раз, т. е. концентрации веществ А и В уменьшились в три раза. Следовательно, после оказанного воздействия
v1 = k(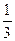 [А])2(
[А])2(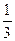 [B]) =
[B]) = 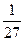 k[А]2[B].
k[А]2[B].
Чтобы ответить на поставленный в задаче вопрос, найдем соотношение
v1/v = 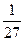 k[А]2[B]/ k[А]2[B] =
k[А]2[B]/ k[А]2[B] = 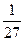 .
.
Следовательно, скорость прямой реакции уменьшится в 27 раз.
б) при увеличении давления (или уменьшении объёма) в n -е количество раз концентрации реагирующих газообразных веществ увеличиваются в такое же количество раз, т. е. при увеличении давления в 2 раза концентрации А и В увеличиваются в два раза. Отсюда
v2 = k(2[А])2(2[B]) = 8k[А]2[B].
Таким образом,
v2/v =8k[А]2[B]/ k[А]2[B] = 8.
Следовательно, скорость прямой реакции увеличится в 8 раза.
Пример 3 – Во сколько раз изменится скорость прямой химической реакции, протекающей в гомогенной системе 2NO + Cl2 = 2NOCl, при:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
а) увеличении концентрации NO в 2 раза;
б) уменьшении концентрации Cl2 в 3 раза.
Решение
а) до оказанного воздействия скорость реакции выражалась уравнением v = k[NO]2[Cl2].
При увеличении концентрации NO в 2 раза
v1 = k(2[NO])2[Cl2]= 4k[NO]2[Cl2].
Тогда
v1/v = 4k[NO]2[Cl2]/ k[NO]2[Cl2] = 4.
Следовательно, скорость прямой реакции увеличится в 4 раза;
б) при уменьшении концентрации Cl 2 в 3 раза
v2 = k[NO]2(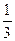 [Cl2]) =
[Cl2]) = 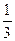 k[NO]2[Cl2].
k[NO]2[Cl2].
Тогда
v2/v = 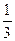 k[NO]2[Cl2]/ k[NO]2[Cl2] =
k[NO]2[Cl2]/ k[NO]2[Cl2] = 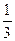 .
.
Следовательно, скорость прямой реакции уменьшится в 3 раза.
Пример 4 – Как скажется уменьшение объёма в четыре раза на скорости следующих реакций:
а) 2С(К) + О2(Г) = 2СО(Г);
б) 2AB(K) = 2A(K) + B(Г).
Решение
а) так как в данной системе одно из веществ (С) находится в кристаллическом состоянии, то его концентрация не будет входить в формулу закона действия масс. Следовательно, v = k[О2]. При уменьшении объёма в 4 раза концентрация О2 увеличивается в 4 раза и v1 = k4[О2] = 4k[О2]. Отсюда v1/v = 4k[О2] / k[О2] = 4 и скорость прямой реакции увеличится в 4 раза;
б) поскольку среди исходных веществ имеется только одно вещество, причём в кристаллическом состоянии, то изменение объёма не будет влиять на скорость прямой реакции и она не изменится.
|
|
