
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетические закономерности гомогенных и гетерогенных процессов различны.
|
|
Все реакции подразделяются на простые и сложные.
Реакции, протекающие в одну стадию, называются простыми, или элементарными. Таких реакций мало.
Понятие молекулярность реакции применимо только к простым реакциям. Молекулярность реакции характеризует число частиц, участвующих в элементарном взаимодействии. Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы, причем тримолекулярных реакций крайне мало, так как крайне мала вероятность одновременного столкновения трех частиц, тем более в правильной взаимной ориентации. Реакции с более высокой молекулярностью неизвестны.
Примеры простых реакций:
– мономолекулярная N2O5 = NO2 + NO + O2;
– бимолекулярная H2 + I2 = 2HI;
– тримолекулярная 2NO + Cl2 = 2NOCl.
Реакции, протекающие в несколько стадий, называются сложными. Таких реакций большинство. Совокупность стадий, из которых состоит химическая реакция, называется механизмом химической реакции. В ходе сложной реакции могут получаться промежуточные короткоживущие частицы – интермедиаты. Сложные реакции, в свою очередь, бывают последовательными, параллельными и последовательно-параллельными. Схематически все типы реакций представлены на рисунке 1, где исходные вещества и продукты реакции соответствуют началу и концу стрелки.

Рисунок 1 – Элементарная и сложные реакции
В сложных реакциях скорость образования конечных продуктов часто зависит от скорости лишь одной, наиболее медленной элементарной реакции. Такая реакция называется лимитирующей.
Понятие молекулярностьприменимо к каждой отдельной стадии, но для сложной реакции в целом применяют понятие порядок реакции. Более подробно порядок реакции будет рассмотрен ниже.
Химическая реакция может протекать только при столкновении реагирующих частиц. Однако не каждое столкновение приводит к взаимодействию, поскольку необходимо преодоление сил отталкивания, возникающих между электронными облаками сталкивающихся частиц. Частицы, обладающие энергией, достаточной для взаимодействия, называются активными. Эта энергия является определенной, характерной для каждой реакции. Дополнительная энергия, которую необходимо сообщить частицам, чтобы перевести их в активное состояние (состояние активированного комплекса), называется энергией активации (Еа). Энергию активации выражают в кДж/моль.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В ходе химической реакции разрушаются одни и возникают другие молекулы и соединения, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые химические связи в ходе реакции сразу полностью разрушались, то потребовалось бы большое количество энергии и реакция протекала бы крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование так называемого активированного комплекса. Например, ход реакции
АВ + DC = AD + BC
можно представить схемой
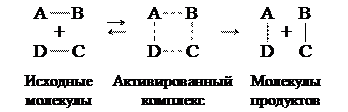
В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его невелико (порядка 10-13 с). При распаде комплекса образуются либо продукты реакции, либо исходные вещества. Для образования переходного комплекса необходима энергия (энергия активации), поэтому переходное состояние имеет более высокую энергию, чем исходное и конечное (рисунок 2).
Помимо достаточной энергии молекул, есть еще одно условие для протекания принципиально возможной реакции: определенная ориентация взаимодействующих частиц в пространстве, благоприятствующая перераспределению электронной плотности.
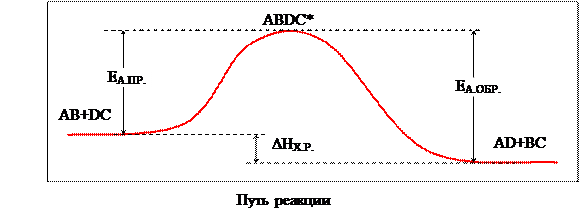
EА.ПР. – энергия активации прямой реакции; EА.ОБР. – энергия активации обратной реакции; ABDC* - активированный комплекс; DHХ.Р. – тепловой эффект реакции
Рисунок 2 – Энергетическая диаграмма хода реакции с образованием активированного комплекса
|
|
