
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача №5.
|
|
а) Запишите выражение константы равновесия для реакции:
4NO2(г) + O2(г) = 2N2O5(г)
Вычислите константу равновесия и начальные концентрации реагентов, если концентрации веществ в момент равновесия были равны: [ NO2 ] = 4 моль/л; [ O2 ] = 2 моль/л; [ N2O5 ] = 6 моль/л.
Алгоритм решения
Выражение для константы химического равновесия данной реакции записывается следующим образом:

Вычислим константу равновесия, подставив выражение значения равновесных концентраций:
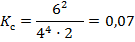
Для удобства дальнейших расчетов сделаем таблицу, где С0 – начальные концентрации реагентов; Δ С – изменение концентрации за промежуток времени; [C] – равновесные концентрации реагентов. Нам известны равновесные концентрации реагентов, занесем их в таблицу. В начальный момент времени концентрация продукта реакции C0(N2O5) = 0.
| C0 | DС | [С] | |
| N2O5 | |||
| NO2 | |||
| O2 |
По ходу решения задачи будем заполнять таблицу.
Итак, в момент равновесия в системе образовалось 6 моль N2O5. Рассчитаем, какие количества вещества исходных реагентов израсходовались в процессе реакции, т.е. определим DС (NO2) и DС (O2).
Согласно уравнению реакции, на образование 2 моль N2O5 расходуется 4 моль NO2 и 1 моль O2.
Составим пропорции, чтобы рассчитать какие количества исходных реагентов пойдут на образование 6 моль N2O5:
4 моль NO2 - 2 моль N2O5 1 моль O2 - 2 моль N2O5
х моль NO2 - 6 моль N2O5 х моль O2 - 6 моль N2O5
х =  = 12 моль х =
= 12 моль х =  = 3 моль
= 3 моль
DС (NO2) = 12 моль DС (O2) = 3 моль.
Т.к. начальная концентрация N2O5 была равна нулю, то DС (N2O5) = [ N2O5 ]
Занесем полученные данные в таблицу:
| C0 | DС | [С] | |
| N2O5 | |||
| NO2 | |||
| O2 |
Рассчитаем начальную концентрацию NO2 . В момент равновесия в системе осталось 4 моль NO2, 12 моль израсходовалось в процессе реакции.
C0(NO2) = DС(NO2) +[ NO2 ]=12 + 4 = 16 моль.
Теперь рассчитаем начальную концентрацию O2. В момент равновесия в системе осталось 2 моль O2 , в процессе реакции израсходовалось 3 моль O2.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
C0(O2) = DС(O2) +[ O2 ] = 2 + 3 = 5 моль.
Заполним таблицу и проведем проверку полученных данных:
| C0 (DС+[С]) | DС | [С] |C0-DС| | |
| N2O5 | |||
| NO2 | |||
| O2 |
Ответ: К = 0, 07; C0(NO2) = 16 моль; C0(O2) = 5 моль.
б) Запишите выражение константы равновесия для реакции:
2NO(г) + Cl2(г) = 2NOCl(г)
Исходные концентрации оксида азота (II) и хлора равны 1 и 0, 5 моль/л. Рассчитайте константу равновесия реакции и концентрации этих веществ в момент времени, когда прореагировало 0, 1 моль хлора.
Алгоритм решения
Выражение для константы равновесия реакции записывается следующим образом:
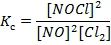
Сделаем таблицу и занесем в нее известные нам данные. Нам известны начальные концентрации исходных реагентов, а также известно что концентрация продукта реакции в начальный момент времени равна нулю. В условии сказано, что в процессе реакции израсходовалось 0, 1 моль Cl2, т.е. Δ С(Cl2) = 0, 1 моль.
| C0 | DС | [С] | |
| NO | |||
| Cl2 | 0, 5 | 0, 1 | |
| NOCl |
Определим, какое количество NO израсходовалось в процессе реакции. Количества исходных реагентов расходуются в процесс реакции пропорционально, в соответствии с коэффициентами в уравнении реакции. Согласно уравнению реакции, 2 моль NO реагирует с 1 моль Cl2. Составим пропорцию, чтобы определить, сколько моль NO прореагирует с 0, 1 моль Cl2:
2 моль NO - 1 моль Cl2
х моль NO2 - 0, 1 моль Cl2
х =  = 0, 2 моль
= 0, 2 моль
Итак, в результате реакции расходуется 0, 2 моль NO, то есть DС(NO) = 0, 2 моль.
Занесем полученные данные в таблицу:
| C0 (DС+[С]) | DС | [С] |C0-DС| | |
| NO | 0, 2 | ||
| Cl2 | 0, 5 | 0, 1 | |
| NOCl |
Рассчитаем количество NOCl, которое образуется, если на реакцию израсходовалось 0, 1 моль Cl2. Согласно уравнению реакции, из 1 моль Cl2 образуется 2 моль NOCl. Составим пропорцию:
1 моль Cl2 - 2 моль NOCl
0, 1 моль Cl2 - х моль NOCl
х =  = 0, 2 моль
= 0, 2 моль
В результате реакции образовалось 0, 2 моль NOCl, т.е. [ NOCl ] = 0, 2 моль/л. Т.к. начальная концентрация продукта реакции была равна нулю, значит DС(NOCl) = [ NOCl ] = 0, 2 моль/л. Занесем данные в таблицу:
| C0 | DС | [С] | |
| NO | 0, 2 | ||
| Cl2 | 0, 5 | 0, 1 | |
| NOCl | 0, 2 | 0, 2 |
Рассчитаем количества исходных реагентов, которые остались в системе, т.е. их равновесные концентрации.
[NO] = C0 (NO) - DС(NO) = 1 - 0, 2 = 0, 8 моль/л
[Cl2] = C0 (Cl2) - DС(Cl2) = 0, 5 - 0, 1 = 0, 4 моль/л
Занесем данные в таблицу и проведем проверку:
| C0 (DС+[С]) | DС | [С] |C0-DС| | |
| NO | 0, 2 | 0, 8 | |
| Cl2 | 0, 5 | 0, 1 | 0, 4 |
| NOCl | 0, 2 | 0, 2 |
Теперь рассчитаем константу равновесия, используя равновесные концентрации реагентов:
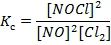
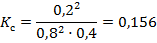
Ответ: [ NO ] = 0, 8 моль/л; [ Cl2 ] = 0, 4 моль/л; Кр = 0, 156
в) Запишите выражение константы равновесия для реакции:
H2(г)+Cl2(г) = 2HCl(г)
Константа равновесия реакции равна 1. Рассчитайте равновесные концентрации всех реагентов, если исходная концентрация водорода была равна 0, 2 моль/л, а исходная концентрация хлора была равна 0, 5 моль/л.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Алгоритм решения
Выражение для константы равновесия реакции записывается следующим образом:

Сделаем таблицу и занесем в нее известные нам данные.
| C0 | DС | [С] | |
| H2 | 0, 2 | ||
| Cl2 | 0, 5 | ||
| HCl |
Возьмем за х изменение концентрации одного из исходных реагентов, например, Δ С(H2) = x. Т.к. стехиометрические коэффициенты в уравнении реакции перед H2 и Cl2 равны, значит на реакцию идут равные количества этих веществ и Δ С(Cl2) = x. Стехиометрический коэффициент перед HCl в два раза больше, чем у исходных реагентов, значит изменение концентрации составит 2х, т.е. Δ С(HCl) = 2x. Т.к. начальная концентрация HCl равна нулю, значит Δ С(HCl) = [ HCl ] = 2х.
Занесем данные в таблицу.
| C0 | DС | [С] | |
| H2 | 0, 2 | х | |
| Cl2 | 0, 5 | х | |
| HCl | 2х | 2х |
Выразим равновесные концентрации исходных реагентов:
[ H2 ] = C0(H2)-DС(H2) = 0, 2-x
[ Cl2 ] = C0(Cl2)-DС(Cl2) = 0, 5-x
Заполним таблицу и проведем проверку:
| C0 (DС+[С]) | DС | [С] |C0-DС| | |
| H2 | 0, 2 | х | 0, 2-х |
| Cl2 | 0, 5 | х | 0, 5-х |
| HCl | 2х | 2х |
Подставим равновесные концентрации реагентов в формулу для константы равновесия:

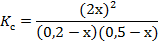
По условию задачи 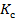 =1. Преобразуем выражение:
=1. Преобразуем выражение:
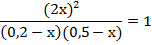
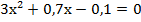
Отсюда находим х = 0, 1 моль/л.
Находим равновесные концентрации всех реагентов:
[ HCl ] = 2х = 2·0, 1 = 0, 2 моль/л
[ H2 ] = 0, 2-x = 0, 2 – 0, 1 = 0, 1 моль/л
[ Cl2 ] = 0, 5-x = 0, 5 – 0, 1 = 0, 4 моль/л
Ответ: [ HCl ] = 0, 2 моль/л; [ H2 ] = 0, 1 моль/л; [ Cl2 ] = 0, 4 моль/л.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №1
1. Напишите кинетическое уравнение реакции:
C2H4(г) + H2(г) = C2H6(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) увеличить концентрацию этилена в 5 раз; в) уменьшить концентрацию водорода в 2 раза?
2. В каком направлении будет происходить смещение равновесия реакции
N2(г) + O2(г) = 2NO(г) ;  =182, 6 кДж
=182, 6 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) понизить концентрацию азота.
3. Во сколько раз возрастет скорость химической реакции при повышении температуры от 20 до 45 0С, если температурный коэффициент скорости реакции равен 2, 3?
4. Рассчитайте энергию активации реакции, если скорость этой реакции при 25 0С в 10 раз больше, чем при 10 0С?
5. Запишите выражение константы равновесия для реакции:
2SO2(г) + O2(г) = 2SO3(г)
Вычислите константу равновесия и начальные концентрации реагентов, если концентрации веществ в момент равновесия были равны: [SO2] = 5 моль/л; [O2] = 1, 3 моль/л; [SO3] = 4 моль/л.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №2
1. Напишите кинетическое уравнение реакции:
CaO(тв) + CO2(г) = CaCO3(тв)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию углекислого газа в 10 раз; в) уменьшить количество оксида кальция в 2 раза?
2. В каком направлении будет происходить смещение равновесия реакции
C(тв) + H2O(г) = CO(г) + H2(г);  =131, 8 кДж
=131, 8 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) понизить концентрацию воды.
3. Во сколько раз возрастет скорость химической реакции при повышении температуры от 0 до 50 0С, если температурный коэффициент скорости реакции равен 3?
4. Во сколько раз изменится скорость реакции при увеличении температуры от 50 до 100 0С, если энергия активации равна 95, 5 кДж/моль?
5. Запишите выражение константы равновесия для реакции:
N2(г) + 3H2(г) = 2NH3(г)
Исходные концентрации азота и водорода равны 2 и 3 моль/л. Рассчитайте концентрации этих веществ в момент времени, когда прореагировало 0, 5 моль азота. Чему равна константа равновесия этой реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №3
1. Напишите кинетическое уравнение реакции:
CO(г) + H2O(г) = CO2(г) +H2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) уменьшить концентрацию оксида углерода (II) в 5 раз; в) увеличить концентрацию воды в 10 раз.
2. В каком направлении будет происходить смещение равновесия реакции
2NO(г) + Cl2(г) = 2NOCl(г);  = - 79, 2 кДж
= - 79, 2 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) понизить концентрацию оксида азота (II).
3. Во сколько раз возрастет скорость реакции при повышении температуры на 50 0С, если температурный коэффициент скорости реакции равен 2, 8?
4. Какова энергия активации реакции, если при 300 К скорость этой реакции в 10 раз больше, чем при 280 К?
5. Запишите выражение константы равновесия для реакции:
H2(г) + Br2(г) = 2HBr(г)
Исходная концентрация водорода равна 1 моль/л, а брома – 0, 6 моль/л. Рассчитайте концентрации всех веществ в системе в момент равновесия, если прореагировало 50% водорода. Чему равна константа равновесия этой реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №4
1. Напишите кинетическое уравнение реакции:
PCl5(г) = PCl3(г) + Cl2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) уменьшить концентрацию хлорида фосфора (V) в 2 раза; в) увеличить концентрацию хлорида фосфора (V) в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
H2(г)+Cl2(г) = 2HCl(г);  = -184, 6 кДж
= -184, 6 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию хлора.
3. Температурный коэффициент скорости реакции равен 2. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 100 раз?
4. Чему равна энергия активации реакции, если при повышении температуры от 290 до 300 К скорость ее увеличивается в 2 раза?
5. Запишите выражение константы равновесия для реакции:
3O2(г) = 2O3(г)
Исходная концентрация кислорода была равна 1, 2 моль/л. Определить концентрации кислорода и озона в момент равновесия, если известно, что к этому времени 75% кислорода превратилось в озон. Чему равна константа равновесия реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №5
1. Напишите кинетическое уравнение реакции:
PH3(г) + GaCl3(тв) = GaP(тв) + 3HCl(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 4 раза; б) увеличить концентрацию фосфина в 7 раз; в) уменьшить концентрацию фосфина в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
CO2(г) + C(тв) = 2CO(г);  = 172, 5 кДж
= 172, 5 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) уменьшить концентрацию углекислого газа.
3. При 393 К реакция заканчивается за 18 минут. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
4. Энергия активации реакции равна 186, 4 кДж/моль. Рассчитайте константу скорости реакции при 700 К, если при 445 К константа скорости равна 0, 942·10-6 л/моль·мин.
5. Запишите выражение константы равновесия для реакции:
4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(ж)
Через некоторое время после начала реакции концентрации веществ стали равны: [ HCl ] = 0, 85 моль/л; [ O2 ] = 0, 44 моль/л; [ Cl2 ] = 0, 3 моль/л. Рассчитайте начальные концентрации исходных реагентов, участвующих в реакции и константу равновесия.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №6
1. Напишите кинетическое уравнение реакции:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию кислорода в 5 раз; в) уменьшить концентрацию аммиака в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
CaO(тв) + CO2(г) = CaCO3(тв);  = -178, 6 кДж
= -178, 6 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) увеличить концентрацию углекислого газа.
3. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 0С скорость реакции возрастает в 15, 6 раза?
4. Чему равна энергия активации реакции, если при повышении температуры от 300 до 310 К скорость реакции увеличивается в 10 раз?
5. Запишите выражение константы равновесия для реакции:
PCl5(г) = PCl3(г) + Cl2(г)
Рассчитать константу равновесия реакции, если к моменту равновесия прореагировало 54% PCl5, а начальная концентрация PCl5 была равна 1 моль/л.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №7
1. Напишите кинетическое уравнение реакции:
CO2(г)+4H2(г) = CH4(г) + 2H2O(ж)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию водорода в 2 раза; в) увеличить концентрацию углекислого газа в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2CO(г) + O2(г) = 2CO2(г) ;  = -566 кДж
= -566 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) увеличить концентрацию кислорода.
3. Температурный коэффициент скорости реакции равен 2, 8. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 75 0С?
4. Энергия активации реакции в отсутствии катализатора равна 84, 6 кДж/моль, а в присутствии катализатора – 60, 6 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при температуре 35 0С?
5. Запишите выражение константы равновесия для реакции:
CO(г) + Cl2(г) = COCl2(г)
Вычислить концентрации всех веществ в момент равновесия, если начальные концентрации веществ равны: С0(CO) = 2 моль/л; С0(Cl2) = 1, 5 моль/л, а константа равновесия К = 20 л/моль.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №8
1. Напишите кинетическое уравнение реакции:
S(тв) + 2N2O(г) = SO2(г) + 2N2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию оксида азота (I) в 3 раза; в) уменьшить концентрацию оксида азота (I) в 5 раз.
2. В каком направлении будет происходить смещение равновесия реакции
CO2(г)+4H2(г) = CH4(г) + 2H2O(г) ;  = -164, 7 кДж
= -164, 7 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию водорода.
3. Температурный коэффициент скорости реакции равен 2, 7. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз?
4. Определите энергию активации реакции, если при 716 К константа скорости реакции равна 0, 0067, а при 787 К равна 0, 159.
5. Запишите выражение константы равновесия для реакции:
2NO2(г) = 2NO(г) + O2(г)
В момент равновесия концентрации веществ в системе были равны: [ NO2 ] = 0, 8 моль/л; [ O2 ] = 1, 1 моль/л; [ NO ] = 2, 2 моль/л. Вычислите константу равновесия и начальную концентрацию оксида азота (IV).
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №9
1. Напишите кинетическое уравнение реакции:
FeO(тв) + CO(г) = Fe(тв) + CO2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) увеличить концентрацию оксида углерода (II) в 6 раз; в) уменьшить концентрацию оксида углерода (II) в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2NO(г) + O2(г) = 2NO2(г);  = -116, 2 кДж
= -116, 2 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) увеличить концентрацию кислорода.
3. Во сколько раз возрастет скорость реакции при повышении температуры на 32 градуса, если температурный коэффициент равен 2, 8?
4. Константа скорости реакции при 600 К равна 7, 5, а при 650 К равна 4, 5·102. Вычислить энергию активации этой реакции.
5. Запишите выражение константы равновесия для реакции:
CO(г) +H2O(г) = CO2(г) +H2(г)
Начальные концентрации исходных веществ равны 0, 08 моль/л. Вычислить равновесные концентрации всех веществ в системе и константу равновесия, если равновесная концентрация [ СO2 ] = 0, 05 моль/л.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №10
1. Напишите кинетическое уравнение реакции:
CS2(г) + 3O2(г) = CO2(г) + 2SO2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) уменьшить концентрацию сероуглерода в 4 раза; в) увеличить концентрацию кислорода в 5 раз.
2. В каком направлении будет происходить смещение равновесия реакции
S(тв) + O2(г) = SO2(г);  = -296, 8 кДж
= -296, 8 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) уменьшить концентрацию кислорода.
3. Вычислить температурный коэффициент скорости, если константа скорости реакции при 120 0С составляет 5, 88·10-4, а при 170 0С равна 6, 2·10-2.
4. Чему равна энергия активации реакции, если при повышении температуры от 320 до 350 К ее скорость увеличивается в 8 раз?
5. Запишите выражение константы равновесия для реакции:
2NO(г) + Cl2(г) = 2NOCl(г)
Исходные концентрации NO и Cl2 были равны соответственно 1 и 5 моль/л.Константа равновесия реакции равна 0, 07. Вычислите концентрации всех веществ в момент равновесия.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №11
1. Напишите кинетическое уравнение реакции:
SO2(г) + 2H2S(г) = 3S(тв) +2H2O(ж)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 3 раза; б) увеличить концентрацию сероводорода в 3 раза; в) увеличить концентрацию оксида серы (IV) в 4 раза.
2. В каком направлении будет происходить смещение равновесия реакции
FeO(тв) + CO(г) = Fe(тв) + CO2(г);  = -11 кДж
= -11 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию оксида углерода (II).
3. Скорость химической реакции при повышении температуры возросла в 124 раза. Температурный коэффициент реакции равен 2, 8. На сколько градусов повысили температуру?
4. Константа скорости некоторой реакции при 20 0С равна 3·10-2, а при 50 0С равна 0, 4. Определите энергию активации реакции.
5. Запишите выражение константы равновесия для реакции:
H2(г) + I2(г) = 2HI(г)
Рассчитайте равновесные концентрации водорода и йода, если их начальные концентрации были равны С0(H2) = 0, 5 моль/л и С0(I2) = 2, 5 моль/л, а равновесная концентрация йодоводорода [ HI ] = 0, 8 моль/л. Чему равна константа равновесия этой реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №12
1. Напишите кинетическое уравнение реакции:
Fe(тв) + H2S(г) = FeS(тв) + H2(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию сероводорода в 4 раза; в) уменьшить концентрацию сероводорода в 5 раз.
2. В каком направлении будет происходить смещение равновесия реакции
H2S(г) + Cl2(г) = 2HCl(г) + S(тв);  = -164 кДж
= -164 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию сероводорода.
3. При 150 0С реакция заканчивается через 16 минут. Температурный коэффициент реакции равен 2, 5. Через какое время закончится реакция при 200 0С?
4. Константа скорости реакции при 600 К равна 7, 5, а при 650 К – 4, 5·102. Вычислите энергию активации, а также константу скорости реакции при 700 К.
5. Запишите выражение константы равновесия для реакции:
N2(г) + 3H2(г) = 2NH3(г)
Концентрации веществ в момент равновесия равны: [ H2 ] = 0, 2 моль/л; [ N2 ] = 0, 1 моль/л; [ NH3 ] = 0, 8 моль/л. Вычислить константу равновесия и начальные концентрации водорода и азота.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №13
1. Напишите кинетическое уравнение реакции:
2H2S(г) + 3O2(г) = 2SO2(г) +2H2O(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию сероводорода в 3 раза; в) уменьшить концентрацию кислорода в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
CH4(г) + 2O2(г) = CO2(г) + 2H2O(г);  = -802, 5 кДж
= -802, 5 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию кислорода.
3. Рассчитайте температурный коэффициент скорости реакции, если при увеличении температуры на 25 0С скорость реакции возрастает в 8 раз.
4. Определите энергию активации реакции, если при увеличении температуры от 330 до 400 К константа скорости реакции увеличилась в 10 раз?
5. Запишите выражение константы равновесия для реакции:
FeO(тв) + CO(г) = Fe(тв) + CO2(г)
Константа равновесия реакции равна 0, 2. Чему равны равновесные концентрации СО и СО2, если начальная концентрация С0(CO) = 0, 5 моль/л?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №14
1. Напишите кинетическое уравнение реакции:
2N2(г) + 6H2O(г) = 4NH3(г) +3O2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) увеличить концентрацию азота в 5 раз; в) уменьшить концентрацию паров воды в 4 раза.
2. В каком направлении будет происходить смещение равновесия реакции
4CO(г)+2SO2(г)=S2(г)+4CO2(г);  = -409, 8 кДж
= -409, 8 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию оксида серы (IV).
3. При температуре 50 0С реакция протекает за 3 минуты. Температурный коэффициент скорости реакции равен 2. За какое время будет протекать реакция при температуре 70 0С?
4. Рассчитайте энергию активации реакции, если ее скорость при 350 К в 20 раз больше, чем при 290 К.
5. Запишите выражение константы равновесия для реакции:
2NO(г) + Cl2(г) = 2NOCl(г)
Начальные концентрации исходных реагентов составляют С0(NO) = 0, 5 моль/л и С0(Cl2) = 0, 2 моль/л. Вычислите константу равновесия, если к моменту равновесия прорегировало 10% NO.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №15
1. Напишите кинетическое уравнение реакции:
H2S(г) + I2(г) = 2HI(г) + S(тв)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 3 раза; б) увеличить концентрацию сероводорода в 4 раза; в) увеличить концентрацию йода в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
Bi2O3(тв)+3H2(г)=2Bi(тв)+3H2O(г);  = 151, 5 кДж
= 151, 5 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) уменьшить концентрацию водорода.
3. При увеличении температуры на 60 0С скорость реакции возросла в 64 раза. Рассчитайте температурный коэффициент скорости реакции.
4. Энергия активации реакции в присутствии катализатора равна 32 кДж/моль, а в отсутствии – 20, 9 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора при 25 0С?
5. Запишите выражение константы равновесия для реакции:
2CO(г) + O2(г) = 2CO2(г)
Чему равна константа равновесия реакции и начальные концентрации СО и O2, если в момент равновесия концентрации веществ были равны: [СО] = 0, 3 моль/л, [O2] = 0, 5 моль/л, [CO2] = 0, 4 моль/л?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №16
1. Напишите кинетическое уравнение реакции:
CH4(г)+2O2(г) = CO2(г) + 2H2O(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) увеличить концентрацию метана в 3 раза; в) уменьшить концентрацию кислорода в 4 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2SO2(г) + O2(г) = 2SO3(г);  = - 197, 8 кДж
= - 197, 8 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию оксида серы (IV).
3. Температурный коэффициент скорости реакции равен 2, 3. Во сколько раз увеличится скорость реакции, если увеличить температуру на 25 0С?
4. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если при добавлении катализатора ее энергия активации понизилась на 4 кДж/моль?
5. Запишите выражение константы равновесия для реакции:
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж)
Через некоторое время после начала реакции концентрации веществ в реакционной смеси стали равны: [NH3] = 0, 01 моль/л, [O2] = 0, 02 моль/л, [NO] = 0, 03 моль/л. Вычислите исходные концентрации аммиака и кислорода и константу равновесия реакции.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №17
1. Напишите кинетическое уравнение реакции:
2CO(г) + O2(г) = 2CO2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) увеличить концентрацию оксида углерода (II) в 2 раза; в) уменьшить концентрацию кислорода в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
N2(г) + 3H2(г) = 2NH3(г);  = -91, 8 кДж
= -91, 8 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию азота.
3. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 20 раз? Температурный коэффициент скорости реакции равен 2, 5.
4. Энергия активации реакции равна 103, 5 кДж/моль. Константа скорости этой реакции при 298 К равна 2, 03·10-3 с-1. Вычислите константу скорости реакции при температуре 400 К.
5. Запишите выражение константы равновесия для реакции:
2HI(г) = H2(г) + I2(г)
Константа равновесия реакции равна 1, 64. Найти концентрации всех веществ в состоянии равновесия, если исходная концентрация йодоводорода была равна 2 моль/л.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №18
1. Напишите кинетическое уравнение реакции:
2NO(г) + Cl2(г) = 2NOCl(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию оксида азота (II) в 4 раза; в) уменьшить концентрацию хлора в 5 раз.
2. В каком направлении будет происходить смещение равновесия реакции
CS2(г) + 3O2(г) = CO2(г) + 2SO2(г);  = -898, 1 кДж
= -898, 1 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) уменьшить концентрацию кислорода.
3. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 35 0С скорость реакции возрастает в 16 раз?
4. Энергия активации некоторой реакции в отсутствии катализатора равна 95, 24 кДж/моль, а в присутствии катализатора – 60 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 35 0С?
5. Запишите выражение константы равновесия для реакции:
COCl2(г) = CO(г) + Cl2(г)
Химическое равновесие реакции установилось при следующих концентрациях веществ: [COCl2] = 1 моль/л, [CO] = 2 моль/л, [Cl2] = 4 моль/л. В систему добавили COCl2 в количестве 0, 5 моль/л.Определите новые равновесные концентрации веществ.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №19
1. Напишите кинетическое уравнение реакции:
H2(г)+Cl2(г) = 2HCl(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) увеличить концентрацию хлора в 3 раза; в) уменьшить концентрацию водорода в 4 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2MgO(тв) + 2F2(г) = 2MgF2(тв) + O2(г);  = -1045, 2 кДж
= -1045, 2 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию фтора.
3. При 80 0С некоторая реакция заканчивается за 16 минут. Сколько понадобится времени для проведения этой реакции при 120 0С. Температурный коэффициент скорости реакции равен 2.
4. Чему равна энергия активации реакции, если при повышении температуры от 300 до 800 К скорость ее увеличивается в 5 раз?
5. Запишите выражение константы равновесия для реакции:
2NO(г) + O2(г) = 2NO2(г)
При некоторой температуре константа равновесия реакции равна 2, 2. В момент равновесия концентрации исходных реагентов были равны: [NO] = 0, 02 моль/л и [O2] = 0, 03 моль/л. Вычислите начальные концентрации исходных реагентов.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №20
1. Напишите кинетическое уравнение реакции:
H2S(г) + Cl2(г) = 2HCl(г) + S(тв)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 3 раза; б) уменьшить концентрацию хлора в 4 раза; в) увеличить концентрацию сероводорода в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
CO(г) +H2O(г) = CO2(г) +H2(г);  = -41, 2 кДж
= -41, 2 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию оксида углерода (II).
3. Вычислите температурный коэффициент скорости реакции, если при повышении температуры от 323 до 373 К скорость реакции увеличилась в 1200 раз.
4. Реакция при 20 0С протекает за 60 с. Сколько времени потребуется для протекания реакции при 40 0С, если энергия активации равна 33, 5 кДж/моль?
5. Запишите выражение константы равновесия для реакции:
N2O4(г) = 2NO2(г)
Найти константу равновесия реакции, если начальная концентрация N2O4 была равна 0, 08 моль/л, а к моменту равновесия диссоциировало 50 % N2O4.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №21
1. Напишите кинетическое уравнение реакции:
CO2(г) + C(тв) = 2CO(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) уменьшить концентрацию оксида углерода (IV) в 3 раза; в) увеличить концентрацию оксида углерода (IV) в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
S(тв) + 2N2O(г) = SO2(г) + 2N2(г);  = -460 кДж
= -460 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию оксида азота (I).
3. При температуре 30 0С реакция протекает за 25 минут, а при температуре 50 0С за 4 минуты. Рассчитайте температурный коэффициент скорости реакции.
4. При понижении температуры с 275 К до 260 К скорость реакции уменьшилась в 5 раз. Чему равна энергия активации реакции?
5. Запишите выражение константы равновесия для реакции:
N2(г) + O2(г) = 2NO(г)
Начальная концентрация азота была равна 1, 56 моль/л, а начальная концентрация кислорода 2, 06 моль/л. Равновесная концентрация оксида азота (II) составила 0, 12 моль/л. Рассчитайте константу равновесия для этой реакции.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №22
1. Напишите кинетическое уравнение реакции:
2SO2(г) + O2(г) = 2SO3(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 3 раза; б) увеличить концентрацию оксида серы (IV) в 5 раз; в) уменьшить концентрацию кислорода в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(ж);  = -1166 кДж
= -1166 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию аммиака.
3. Температурный коэффициент скорости реакции равен 3. Как изменится скорость реакции при понижении температуры с 80 до 50 0С?
4. При повышении температуры с 290 до 300 К скорость реакции увеличилась в 2 раза. Чему равна энергия активации реакции?
5. Запишите выражение константы равновесия для реакции:
CO(г) +H2O(г) = CO2(г) +H2(г)
Начальная концентрация СО была равна 0, 1 моль/л, начальная концентрация H2O - 0, 4 моль/л. Вычислите равновесные концентрации веществ, если константа равновесия при постоянной температуре равна 1.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №23
1. Напишите кинетическое уравнение реакции:
4NO2(г) + O2(г) = 2N2O5(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 4 раза; б) уменьшить концентрацию оксида азота (IV) в 2 раза; в) увеличить концентрацию кислорода в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г);  = -1036 кДж
= -1036 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию сероводорода.
3. Температурный коэффициент скорости реакции равен 3. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 243 раза?
4. Энергия активации реакции при температуре 25 0С равна в отсутствии катализатора 80 кДж/моль, а в присутствии катализатора – 52 кДж/моль. Во сколько раз увеличится скорость реакции в присутствии катализатора?
5. Запишите выражение константы равновесия для реакции:
N2(г) + 3H2(г) = 2NH3(г)
Константа равновесия реакции равна 0, 1. Равновесная концентрация водорода равна 0, 6 моль/л, а равновесная концентрация аммиака равна 0, 2 моль/л. Вычислите начальную и равновесную концентрации азота.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №24
1. Напишите кинетическое уравнение реакции:
4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 2 раза; б) уменьшить концентрацию хлороводорода в 2 раза; в) увеличить концентрацию кислорода в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2NO2(г) = 2NO(г) + O2(г);  = 116, 2 кДж
= 116, 2 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) уменьшить концентрацию оксида азота (IV).
3. Во сколько раз возрастет скорость реакции, если повысить температуру на 50 0С? Температурный коэффициент скорости реакции равен 2.
4. За какое время пройдет реакция при 60 0С, если при 20 0С она заканчивается за 40 с, а энергия активации равна 126 кДж/моль.
5. Запишите выражение константы равновесия для реакции:
C(тв) + O2(г) = CO2(г)
Исходная концентрация кислорода была равна 2, 5 моль/л, в момент равновесия концентрация оксида углерода (IV) равна 0, 5 моль/л. Чему равна константа равновесия реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №25
1. Напишите кинетическое уравнение реакции:
Bi2O3(тв)+3H2(г)=2Bi(тв)+3H2O(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию водорода в 3 раза; в) уменьшить концентрацию водорода в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
O3(г) + NO(г) = O2(г) + NO2(г);  = -200, 8 кДж
= -200, 8 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) уменьшить концентрацию оксида азота (II).
3. При 393 К реакция заканчивается за 18 минут. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости реакции равен 3?
4. Энергия активации реакции равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 0С?
5. Запишите выражение константы равновесия для реакции:
H2(г) + Br2(г) = 2HBr(г)
Равновесие в системе установилось при следующих концентрациях: [H2] = 0, 5 моль/л; [Br2] = 0, 1 моль/л и [HBr] =1, 6 моль/л. Определить исходные концентрации водорода и брома и константу равновесия реакции.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №26
1. Напишите кинетическое уравнение реакции:
SbH3(г) + GaCl3(г) = GaSb(тв) +3HCl(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию хлорида галлия в 2 раза; в) уменьшить концентрацию гидрида сурьмы в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
2Sb2S3(тв) + 9O2(г) = 2Sb2O3(г) + 6SO 2 (г) ;  = -4906, 8 кДж
= -4906, 8 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) увеличить концентрацию кислорода.
3. При повышении температуры на 27, 8 0С скорость реакции возросла в 6, 9 раза. Вычислить температурный коэффициент скорости реакции.
4. Константа скорости реакции при 20 0С равна 3·10-2, а при 50 0С – 0, 4. Определить энергию активации реакции.
5. Запишите выражение константы равновесия для реакции:
3 А(г) + В(г) = 2 С(г) + D(г)
В момент равновесия концентрации веществ были равны: [А] = 3 моль/л, [В] = 1 моль/л, [С] = 0, 8 моль/л. Рассчитайте константу равновесия и исходные концентрации веществ А и В.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №27
1. Напишите кинетическое уравнение реакции:
C(тв) + H2O(г) = CO(г) + H2(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 3 раза; б) увеличить концентрацию паров воды в 3 раза; в) уменьшить концентрацию паров воды в 2 раза.
2. В каком направлении будет происходить смещение равновесия реакции
S(тв) + 2N2O(г) = SO2(г) + 2N2(г) ;  = -460 кДж
= -460 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) увеличить концентрацию оксида азота (I).
3. Определить температурный коэффициент скорости реакции, если при понижении температуры на 45 0С реакция замедлилась в 25 раз.
4. Реакция протекает при 20 0С. Энергия активации реакции в отсутствии катализатора равна 75 кДж/моль, а в присутствии катализатора – 50 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора?
5. Запишите выражение константы равновесия для реакции:
H2(г) + I2(г) = 2HI(г)
Вычислить константу равновесия реакции, если начальная концентрация H2была равна 0, 5 моль/л, начальная концентрация I2 - 0, 2 моль/л и к моменту равновесия прореагировало 20% водорода.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №28
1. Напишите кинетическое уравнение реакции:
S(тв) + 2N2O(г) = SO2(г) + 2N2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 4 раза; б) увеличить концентрацию оксида азота (I) в 2 раза; в) уменьшить концентрацию оксида азота (I) в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
C2H4(г) + H2(г) = C2H6(г);  = -136, 4 кДж
= -136, 4 кДж
если: а) увеличить температуру; б) увеличить давление в системе; в) увеличить концентрацию этилена.
3. Во сколько раз увеличится скорость химической реакции при повышении температуры от 20 до 170 0С, если было установлено, что при повышении температуры на каждые 25 0С скорость реакции возрастает в 6 раз?
4. Энергия активации реакции равна 186, 4 кДж/моль. Константа скорости этой реакции при температуре 456 К равна 0, 942·10-6 л/моль·мин. Чему равна константа скорости этой реакции при 700 К?
5. Запишите выражение константы равновесия для реакции:
A(г) + B(г) = 2C(г)
Константа равновесия реакции равна 4. Определите равновесные концентрации веществ, если начальная концентрация А составляла 5 моль/л, а начальная концентрация В - 4 моль/л.
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №29
1. Напишите кинетическое уравнение реакции:
4CO(г)+2SO2(г)=S2(г)+4CO2(г)
Как изменится скорость реакции, если: а) в системе уменьшить давление в 2 раза; б) увеличить концентрацию оксида серы (IV) в 3 раза; в) уменьшить концентрацию оксида углерода (II) в 5 раз.
2. В каком направлении будет происходить смещение равновесия реакции
A(г) + 2B(тв) = C(г) + 2D(ж);  = 20 кДж
= 20 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) увеличить концентрацию вещества А.
3. Скорость химической реакции при температуре 10 0С составляет 1 моль/л·с. Температурный коэффициент скорости этой реакции равен 2. Чему равна скорость этой реакции при температуре 70 0С?
4. При повышении температуры от 27 до 40 0С скорость реакции увеличилась в 2, 8 раза. Чему равна энергия активации реакции?
5. Запишите выражение константы равновесия для реакции:
C(тв) + CO2(г) = 2CO(г)
Начальная концентрация оксида углерода (IV) составляла 3, 25 моль/л, а равновесная концентрация оксида углерода (II) – 2 моль/л. Чему равна константа равновесия реакции?
Индивидуальное задание «Химическая кинетика. Химическое равновесие»
ВАРИАНТ №30
1. Напишите кинетическое уравнение реакции:
O3(г) + NO(г) = O2(г) + NO2(г)
Как изменится скорость реакции, если: а) в системе увеличить давление в 3 раза; б) увеличить концентрацию озона в 2 раза; в) увеличить концентрацию оксида азота (II) в 3 раза.
2. В каком направлении будет происходить смещение равновесия реакции
SbH3(г) + GaCl3(г) = GaSb(тв) +3HCl(г);  = 60, 9 кДж
= 60, 9 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) увеличить концентрацию хлорида галлия (III).
3. Температурный коэффициент скорости реакции равен 4. На сколько градусов нужно увеличить температуру, чтобы скорость реакции возросла в 64 раза?
4. Определите энергию активации реакции, константа скорости которой при 298 К равна 3, 1·10-4, а при 313 К составляет 8, 2·10-3.
5. Запишите выражение константы равновесия для реакции:
A(г) + 2B(г) = C(г)
Определите константу равновесия и исходные концентрации веществ А и В, если равновесные концентрации были равны: [A] = 0, 3моль/л, [B] = 0, 6 моль/л, [C] = 1, 08 моль/л.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что изучает химическая кинетика?
2. Что такое гомогенные и гетерогенные реакции?
3. Дайте определение скорости химической реакции.
4. От каких факторов зависит скорость химической реакции?
5. Как зависит скорость химической реакции от концентраций реагентов?
6. Сформулируйте закон действующих масс для скорости химической реакции. Приведите его математическое выражение.
7. Что такое константа скорости реакции? От чего она зависит?
8. Как зависит скорость химической реакции от температуры?
9. Сформулируйте правило Вант-Гоффа, приведите его математическое выражение.
10. Что показывает температурный коэффициент скорости реакции?
11. Дайте определение энергии активации реакции. От чего она зависит?
12. Что такое катализатор?
13. Каков механизм действия катализатора?
14. Приведите уравнение Аррениуса, поясните какие величины входят в это выражение.
15. Дайте определение химического равновесия.
16. Что такое константа равновесия? Напишите математическое выражение для константы равновесия, поясните, какие величины туда входят.
17. Сформулируйте принцип Ле-Шателье.
18. Какие факторы влияют на смещение химического равновесия в системе и каким образом?
|
|
