
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача №4.
|
|
а) Во сколько раз изменится скорость реакции при увеличении температуры от 30 до 45 0С, если энергия активации равна 100 кДж/моль? За какое время будет протекать реакция при 45 0С, если при 30 0С она протекает за 5 минут?
Алгоритм решения
С ростом температуры увеличивается константа скорости химической реакции, и соответственно, скорость реакции. Согласно уравнению Аррениуса:
 .
.
Запишем уравнение Аррениуса при конечной и начальной температурах, учитывая, что энергия активации 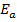 и предэкспоненциальный множитель
и предэкспоненциальный множитель 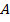 - постоянные величины для данной химической реакции. Т.к. константа скорости прямопропорциональна скорости реакции
- постоянные величины для данной химической реакции. Т.к. константа скорости прямопропорциональна скорости реакции 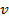 , мы можем использовать ее для дальнейших расчетов.
, мы можем использовать ее для дальнейших расчетов.
При начальной температуре:

При конечной температуре:

Запишем соотношение констант скоростей при конечной и начальной температурах:

Преобразуем выражение:
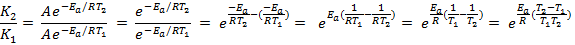
Прологарифмируем полученное выражение:

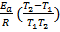
Подставим данные, учитывая размерность энергии активации. Для расчета ее необходимо перевести в Дж, т.е. добавить множитель 103.
Температуру необходимо перевести в K: 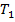 = 273 + 30 = 303 K,
= 273 + 30 = 303 K, 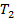 = 273 + 45 = 318 K
= 273 + 45 = 318 K


Т.к. соотношение констант скоростей пропорционально соотношению скоростей реакции, то
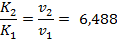
Время протекания реакции обратнопропорционально ее скорости, отсюда:
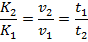
Выразим отсюда 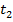 :
:


Переведем время в секунды: 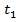 = 5 мин = 5·60 с = 300 с
= 5 мин = 5·60 с = 300 с
Находим t2:
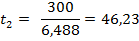
Ответ: скорость реакции возрастет в 6, 488 раз; время протекания реакции 46, 23 с.
б) Энергия активации реакции в отсутствии катализатора равна 92 кДж/моль, а в присутствии катализатора равна 42 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при температуре 120 0С?
Алгоритм решения
В присутствии катализатора путь химической реакции изменяется, что приводит к снижению энергии активации. Т.к. скорость реакции связана с константой скорости прямопропорционально, т.е. 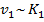 ,
, 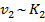 , для решения задачи можно использовать уравнение Аррениуса. Запишем уравнение Аррениуса для химической реакции в присутствии катализатора и в его отсутствие, учитывая, что температура постоянна.
, для решения задачи можно использовать уравнение Аррениуса. Запишем уравнение Аррениуса для химической реакции в присутствии катализатора и в его отсутствие, учитывая, что температура постоянна.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Без катализатора:

В присутствии катализатора:
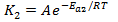
Запишем соотношение констант скоростей:

Преобразуем выражение:

Для расчета необходимо перевести температуру в K:  = 120+273 = 393 K. При этом необходимо учесть размерность энергии активации и перевести её в Дж, т.е. добавить множитель 103.
= 120+273 = 393 K. При этом необходимо учесть размерность энергии активации и перевести её в Дж, т.е. добавить множитель 103.

Ответ: увеличится в 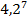 раз.
раз.
в) Вычислите энергию активации реакции, если константа скорости реакции при температуре 200 K равна 4·102, а при температуре 400 K равна 1·105. Чему равна константа скорости при температуре 700 K?
Алгоритм решения
Запишем соотношения констант скоростей при температурах 200 и 400 K:

Преобразуем выражение и выразим из него энергию активации:

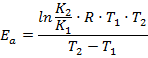
Рассчитаем энергию активации реакции:

Для расчета константы скорости  при температуре
при температуре  , равной 700 K, воспользуемся уравнением Аррениуса и значением одной из констант, например,
, равной 700 K, воспользуемся уравнением Аррениуса и значением одной из констант, например,  :
:

Выразим отсюда  :
:
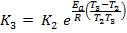
Прологарифмируем выражение:
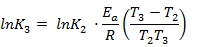
Рассчитаем К3:


Ответ: Еа = 18, 53 кДж; К3 = 6, 7·108.
|
|
