
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача №2.
|
|
а) В каком направлении будет происходить смещение равновесия реакции
H2(г) + Br2(г) = 2HBr(г); 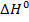 = -72, 6 кДж
= -72, 6 кДж
если: а) увеличить температуру; б) уменьшить давление в системе; в) понизить концентрацию водорода.
Алгоритм решения
а) Т.к. 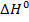 < 0, реакция является экзотермической, т.е. протекает с выделением тепла. Соответственно, обратный процесс является эндотермическим и протекает с поглощением тепла. При увеличении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с поглощением тепла. Таким образом, увеличивается скорость эндотермического процесса, и равновесие смещается влево, в сторону обратной реакции.
< 0, реакция является экзотермической, т.е. протекает с выделением тепла. Соответственно, обратный процесс является эндотермическим и протекает с поглощением тепла. При увеличении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с поглощением тепла. Таким образом, увеличивается скорость эндотермического процесса, и равновесие смещается влево, в сторону обратной реакции.
б) Если уменьшить давление в системе, то смещение равновесия будет в том направлении, где происходит увеличение давления, т.е. образование большего числа молей газов. В данном случае число молей газообразных веществ в левой и в правой части уравнения одинаково, т.е. в результате протекания химической реакции не будет происходить изменения давления в системе. При уменьшении давления в системе смещения равновесия не происходит.
в) Если понизить концентрацию одного из реагентов, то смещение равновесия будет происходить в том направлении, где концентрация этого вещества будет повышаться. При понижении концентрации водорода возрастет скорость обратного процесса, т.е. процесса, при котором происходит образование водорода. Таким образом, равновесие будет смещаться влево, в сторону обратной реакции.
Ответ: а) в сторону обратной реакции; б) не смещается; в) в сторону обратной реакции.
б) В каком направлении будет происходить смещение равновесия реакции
4HF(г) +O2(г) = 2F2(г) +2H2O(г); 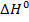 = 63 кДж
= 63 кДж
если: а) уменьшить температуру; б) увеличить давление в системе; в) повысить концентрацию фтороводорода.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Алгоритм решения
а) Т.к. 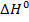 > 0, реакция является эндотермической, т.е. протекает с поглощением тепла. Соответственно, обратный процесс является экзотермическим и протекает с выделением тепла. При уменьшении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с выделением тепла. Таким образом, увеличивается скорость экзотермического процесса, и равновесие смещается влево, в сторону обратной реакции.
> 0, реакция является эндотермической, т.е. протекает с поглощением тепла. Соответственно, обратный процесс является экзотермическим и протекает с выделением тепла. При уменьшении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с выделением тепла. Таким образом, увеличивается скорость экзотермического процесса, и равновесие смещается влево, в сторону обратной реакции.
б) Если увеличить давление в системе, то смещение равновесия будет в том направлении, где происходит уменьшение давления, т.е. образование меньшего числа молей газов. В данном случае число молей газообразных веществ в левой части уравнения больше (4 моль HF и 1 моль O2 – в сумме 5 моль), чем в правой (2 моль F2 и 2 моль H2O – в сумме 4 моль). Таким образом, при увеличении давления равновесие в системе будет смещаться в сторону образования продуктов, т.е. в сторону прямой реакции.
в) Если повысить концентрацию одного из исходных реагентов, то смещение равновесия будет происходить в том направлении, где концентрация этого вещества будет понижаться. При повышении концентрации фтороводорода возрастет скорость прямого процесса, при котором происходит уменьшение концентрации фтороводорода. Таким образом, равновесие будет смещаться вправо, в сторону прямой реакции.
Ответ: а) в сторону обратной реакции; б) в сторону прямой реакции; в) в сторону прямой реакции.
в) В каком направлении будет происходить смещение равновесия реакции
3А(г) +В(тв) = 3С(г) +2D(г); 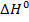 = -105 кДж
= -105 кДж
если: а) уменьшить температуру; б) уменьшить давление в системе; в) повысить концентрацию вещества A.
Алгоритм решения
а) Т.к. 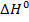 < 0, реакция является экзотермической, т.е. протекает с выделением тепла. Соответственно, обратный процесс является эндотермическим и протекает с поглощением тепла. При уменьшении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с выделением тепла. Таким образом, увеличивается скорость экзотермического процесса, и равновесие смещается вправо, в сторону прямой реакции.
< 0, реакция является экзотермической, т.е. протекает с выделением тепла. Соответственно, обратный процесс является эндотермическим и протекает с поглощением тепла. При уменьшении температуры будет повышаться скорость того процесса, который компенсирует внешнее воздействие, т.е. протекает с выделением тепла. Таким образом, увеличивается скорость экзотермического процесса, и равновесие смещается вправо, в сторону прямой реакции.
б) Если уменьшить давление в системе, то смещение равновесия будет в том направлении, где происходит увеличение давления, т.е. образование большего числа молей газов. В данном случае число молей газообразных веществ в левой части уравнения меньше (3 моль А), чем в правой (3 моль С и 2 моль D – в сумме 5 моль). Таким образом, при понижении давления равновесие в системе будет смещаться в сторону образования продуктов реакции, т.е. в сторону прямого процесса.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
в) Если повысить концентрацию одного из исходных реагентов, то смещение равновесия будет происходить в том направлении, где концентрация этого вещества будет понижаться. При повышении концентрации вещества A возрастет скорость прямого процесса, при котором происходит уменьшение концентрации этого реагента. Таким образом, равновесие будет смещаться вправо, в сторону прямой реакции.
Ответ: а) в сторону прямой реакции; б) в сторону прямой реакции; в) в сторону прямой реакции.
|
|
