
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость реакции
|
|
Скорость подавляющего большинства химических реакций при повышении температуры возрастает, причём очень значительно. Например, рассмотрим реакцию синтеза воды:
2H2(г.) + O2(г.) ® H2O(г.).
С выходом продукта 15 % данная реакция протекает:
- при t = 20 °C – за 54 миллиарда лет (т. е. является практически невозможной);
- при t = 500 °C – за 5 минут;
- при t = 700 °C – мгновенно со взрывом (т. н. «гремучий газ»).
Зависимость скорости реакции от температуры приближённо описывается правилом Вант-Гоффа (предложено Я.Х. Вант-Гоффом в 1884 г.): при повышении температуры на каждые 10 °С скорость гомогенной реакции увеличится в 2 – 4 раза:
 , ,
| (3.21) |
где ut 1 – скорость реакции при температуре t 1; ut 2 – скорость реакции при температуре t 2;
g – температурный коэффициент реакции или коэффициент Вант-Гоффа (для различных реакций g = 2 - 4). 
Пример 3.6. Во сколько раз возрастёт скорость некоторой гомогенной реакции при увеличении температуры на 25 °C, если температурный коэффициент этой реакции g = 2, 3?
Решение:
Из формулы (3.21) отношение скоростей реакции после и до повышения температуры:
 .
.
Ответ: скорость реакции увеличится примерно в 8 раз.
Пример 3.7. Температурный коэффициент одной гомогенной реакции g A = 2, 0, а другой – g B = 2, 5. При температуре t 1 = 25 °C скорости этих реакций равны uA , t 1 = u B , t 1. Рассчитайте отношение скоростей реакций  при температуре t 2 = 95 °C.
при температуре t 2 = 95 °C.
Решение:
Из формулы (3.21) отношение скоростей реакций:
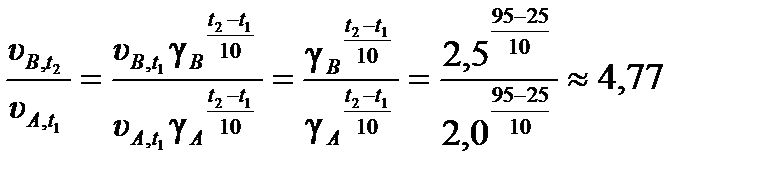 .
.
Ответ:  .
.
Более точно влияние температуры на скорость реакции описывается теорией активных столкновений, в основе которой лежат следующие положения:
1. Протекание реакции обусловлено столкновением частиц (молекул, атомов, ионов, радикалов) реагентов.
2. Столкновение частиц приводит к химическому взаимодействию только в том случае, если энергия столкновения превосходит некоторую минимальную величину, называемую энергией активации Ea.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
3. Столкновение частиц приводит к химическому взаимодействию только в том случае, если частицы ориентированы в пространстве определённым образом друг относительно друга, благоприятным для протекания реакции.
Частицы реагентов распределяются по кинетическим энергиям E в соответствии с распределением Максвелла - Больцмана (в 1859 г. предложено Д.К. Максвеллом для молекул газа, в 1868 – 72 гг. обобщено Л.Э. Больцманом на случай, когда газ находится во внешнем поле). Данное распределение описывается сложной кривой, которая изменяется с увеличением температуры T (см. рис. 3.3). Кривая распределения круто поднимается и, пройдя через максимум, асимптотически приближается к оси абсцисс. Максимум на кривой отвечает наиболее вероятной кинетической энергии частицы при данной температуре. Площадь под кривой распределения равна общему числу частиц реагентов N. Реакционноспособными являются только те частицы, кинетическая энергия которых выше энергии активации Ea. Таким образом, энергия активации – это минимальная избыточная энергия теплового движения частиц в реакционной смеси, благодаря которой при столкновении частиц возможно химическое взаимодействие. Другими словами, энергия активации – это своеобразный энергетический барьер, отделяющий реагенты от продуктов реакции. Заштрихованная площадь под кривой распределения равна числу реакционноспособных частиц NE (см. рис. 3.3). С увеличением температуры NE быстро растёт, следовательно, растёт и скорость реакции.
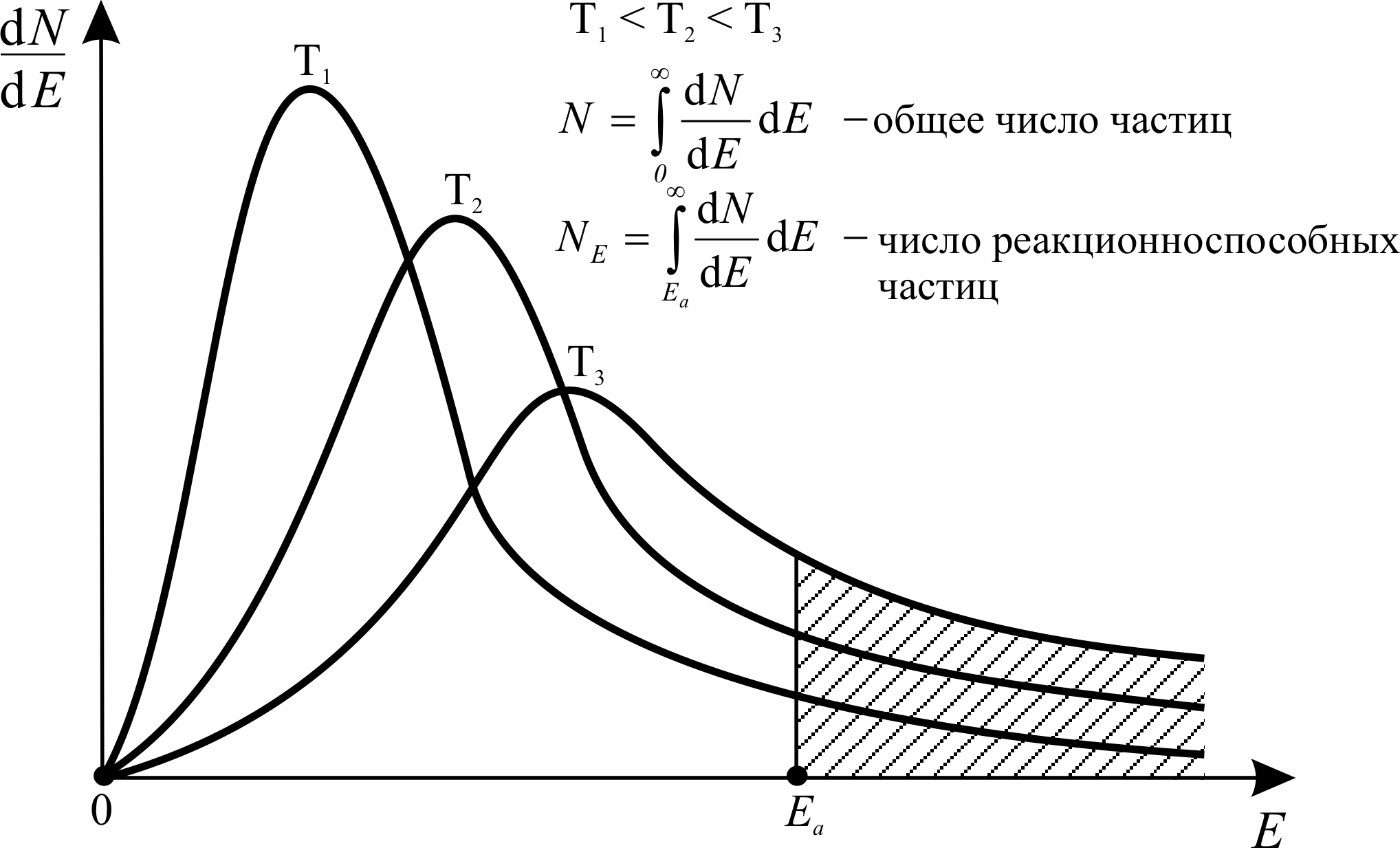
Рис. 3.3. Кривые распределения частиц реагентов по кинетическим энергиям E
(распределение Максвелла - Больцмана)
Зависимость константы скорости реакции k от температуры T выражается уравнением Аррениуса (предложено в 1889 г. С.А. Аррениусом):
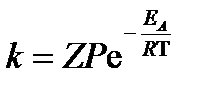 , ,
| (3.22) |
где Z – число столкновений частиц за 1 с в 1 м3 реакционной смеси;
P – стерический множитель.
Стерический множительP – это величина, пропорциональная отношению числа благоприятных для протекания реакции способов взаимной ориентации частиц в пространстве к общему числу возможных способов ориентации. Обычно P значительно меньше единицы. Произведение ZP в уравнении (3.22) часто обозначают символом A и называют предэкспоненциальным множителем или фактором частоты эффективных столкновений молекул:
 , ,
| (3.23) |
Из уравнения Аррениуса (3.22) – (3.23) следует, что большую скорость имеют реакции, для которых энергия активации Ea мала (при одинаковых значения температуры, концентрации реагентов и предэкспоненциального множителя А).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Значения Ea и А для данной реакции можно определить графически, зная зависимость константы скорости реакции k от температуры T. Переведём уравнение Аррениуса (3.23) в логарифмическую форму:
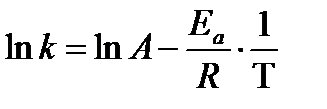 , ,
| (3.24) |
Из формулы (3.24) видно, что зависимость ln k от 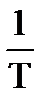 имеет линейный характер. Следовательно, построив зависимость ln k от
имеет линейный характер. Следовательно, построив зависимость ln k от 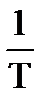 , можно найти Ea и А из простых соотношений:
, можно найти Ea и А из простых соотношений: 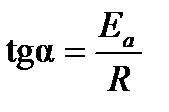 , 0 A = ln A (см. рис. 3.4).
, 0 A = ln A (см. рис. 3.4).

| Рис. 3.4.Схема графического определения и энергии активации Ea и предэкспоненциального множителя A |
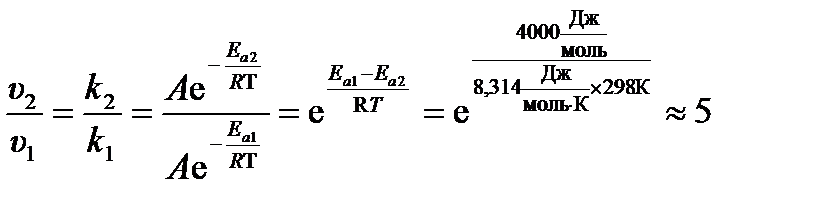
Пример 3.8. Во сколько раз увеличится скорость реакции, протекающей при Т = 298К, если её энергию активации Ea уменьшить на 4  ?
?
Решение:
Отношение скоростей реакции после и до уменьшения энергии активации  равно
равно
отношению констант скоростей 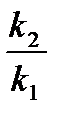 . Тогда из формулы (3.23):
. Тогда из формулы (3.23):
 .
.
Ответ: скорость реакции увеличится примерно в 5 раз.
Пример 3.9. Энергия активации реакции
O3(г.) + NO(г.) ® O2(г.) + NO2(г.)
равна 10  . Во сколько раз увеличится скорость реакции при повышении температуры от 300 до 310 К?
. Во сколько раз увеличится скорость реакции при повышении температуры от 300 до 310 К?
Решение:
Из формулы (3.23):
 .
.
Ответ: скорость реакции увеличится примерно в 1, 14 раз.
|
|
