
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Строение мицеллы
|
|
Основной структурной единицей коллоидного раствора является мицелла. Причем частицы дисперсной фазы обладают сложной структурой, зависящей от условий получения золей и природы стабилизатора. Рассмотрим строение золя йодида серебра, полученного приливанием раствора нитрата серебра к раствору иодида калия (избыток KI - стабилизатор):
KI + AgNO3 → AgI↓ + KNO3.
Образующиеся в результате реакции мелкие кристаллы AgI находятся в растворе, содержащем ионы К+, NO3-, I-. Начинается процесс адсорбции ионов на кристаллах AgI.
Согласно правилу Панета–Фаянса на кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл. В данном случае в соответствии с правилом Панета–Фаянса на кристалле AgI будут адсорбироваться ионы I-.
Адсорбция ионов I- происходит за счет химических сил, приводящих к прочному присоединению их к кристаллу. При этом поверхность кристалла заряжается отрицательно. Ионы I-, сообщившие поверхности заряд, называются потенциалообразующими ионами.
Оставшиеся в растворе противоположно заряженные ионы (противоионы) электростатически притягиваются к поверхности. Слой противоионов компенсирует заряд твердой поверхности. Таким образом, на границе фаз образуется двойной электрический слой (ДЭС), который состоит из двух частей.
Первая часть – это противоионы, непосредственно примыкающие к заряженной поверхности кристалла и удерживающиеся за счет электростатических и адсорбционных сил. Эти ионы вместе с потенциалообразующими ионами составляют адсорбционную часть ДЭС (слой Гельмгольца). Противоионы адсорбционного слоя настолько прочно удерживаются поверхностью, что, не отрываясь, передвигаются вместе с твердой частицей и образуют с ней коллоидную частицу.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Вторая часть – остальные противоионы, которые совершают тепловое движение около заряженной поверхности и удерживаются вблизи нее только за счет действия электростатических сил. Эти ионы образуют диффузионную часть ДЭС (слой Гуи).
Таким образом, строение золя иодида серебра можно записать следующим образом:
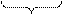 { m [AgI] ∙ n I-∙ (n – x)K+} x - ∙ x K+
{ m [AgI] ∙ n I-∙ (n – x)K+} x - ∙ x K+
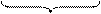 агрегат
агрегат
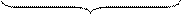 ядро
ядро
 коллоидная частица
коллоидная частица
мицелла
где m – число молекул AgI, образующих кристаллик;
n – число потенциалообразующими ионов (как правило, т> n);
x – число противоионов диффузного слоя;
(n–x) – число противоионов в адсорбированном слое. Число таких ионов калия меньше числа адсорбированных ионов йода (n), вследствие чего коллоидная частица имеет отрицательный заряд (x –).
Агрегат – частица дисперсной фазы, представляющая собой агрегат молекул ультрамикроскопических размеров.
Ядро мицеллы – часть мицеллы, состоящая из агрегата и потенциалопределяющих ионов.
Коллоидная частица – ядро вместе с частью прочно связанных с ним противоионов. В отличие от мицеллы, коллоидная частица имеет заряд (положительный или отрицательный).
Мицелла – частица дисперсной фазы вместе с окружающим ее диффузным слоем, она электрически нейтральна.
Если получать золь йодистого серебра при некотором избытке AgNO3, то частицы золя йодистого серебра приобретают (в отличие от предыдущего случая) положительный заряд:
{ m [AgI] ∙ n Ag+ ∙ (n–х) NO3} х +∙ х NO3-.
Устойчивость коллоидных систем
Коллоидные системы являются термодинамически неустойчивыми, так как обладают избыточной поверхностной энергией, связанной с наличием большой удельной площади поверхности дисперсной фазы. Уменьшение свободной энергии может происходить за счет укрупнения частиц путем их слипания или за счет растворения.
Под устойчивостью дисперсной системы понимают способность дисперсной фазы сохранять состояние равномерного распределения в дисперсионной среде. Н. П. Песков ввел понятия об агрегативной и седиментационной (кинетической) устойчивости.
Седиментационная устойчивость - способность дисперсной системы сохранять неизменным во времени распределение частиц по объему системы, т. е. способность системы противостоять действию силы, тяжести.
Агрегативная устойчивость — способность дисперсной системы сохранять неизменной во времени степень дисперсности, т. е. размеры частиц и их индивидуальность. Агрегативная устойчивость определяет способность дисперсной системы противодействовать слипанию, слиянию частиц. При нарушении агрегативной устойчивости происходит коагуляция.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Коагуляция - процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою седиментационную устойчивость, т.к. частицы становятся слишком крупными и не могут участвовать в броуновском движении.
Коагуляция может быть вызвана повышением температуры, добавлением электролитов, механическим воздействием, действием на данный золь другого, противоположно заряженного золя, ультрацентрифугированием, старением золя за счет протекания реакций. Искусственно вызванное выпадение осадков из атмосферы (дождей) является примером коагуляции аэрозолей воды (облака) при действии электролитов, часто AgNO3.
Основное условие уменьшения устойчивости коллоидных растворов – потеря электрического заряда, поэтому в основном методами коагулирования являются методы снятия зарядов. На практике для этой цели чаще всего воздействуют на коллоидные системы растворами электролитов. Коагуляция золей начинается при концентрациях электролитов выше некоторой критической, называемой порогом коагуляции:
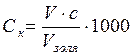 ,
,
где Ск – порог коагуляции, ммоль/дм3; V –объем электролита, вызвавший коагуляцию, дм3; с – концентрация электролита-коагулянта, моль/дм3; Vзоля –объем золя, дм3.
Правило Шульце-Гарди. Чем выше заряд иона-коагулятора, тем в меньшей концентрации он способен вызвать явную коагуляцию коллоидного раствора. Знак коагулирующего иона противоположен знаку потенциалопределяющего иона. Правило Шульце-Гарди иногда называют правилом знака и валентности:
Согласно правилу Шульце-Гарди порог коагуляции золя электролитом Ск обратно пропорционален заряду коагулирующего иона Z, в шестой степени:
CKI: CKII : CKIII = 1: 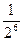 :
: 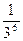 или CK = α
или CK = α 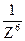
где α — постоянная для данной системы величина;
Z — заряд иона-коагулянта;
CKI, CKII, CKIII — порог коагуляции однозарядного, двухзарядного, трехзарядного иона-коагулянта.
Работа 1. Получение дисперсных систем
Цель работы. Освоение методик получения золей.
Приборы и реактивы.
1. Колбы стеклянные емкостью 100 и 250 см3.
2. Мерные цилиндры емкостью 25, 50 и 100 см3.
3. Большая пробирка.
4. Пипетки емкостью 1, 2, 5, 20 см3.
5. Электрическая плитка закрытого типа.
6. Водный раствор FeCl3 (2 %-ный)..
7. Водный раствор KMnO4 (1, 5 %-ный).
8. Водный раствор Na2S2O3 (1 %-ный).
9. Концентрированный раствор NН4ОН.
10. Раствор серы в ацетоне насыщенный.
11. Раствор парафина в этиловом спирте насыщенный.
12. Водный раствор СаСl2 (4 моль/дм3).
13. Водный раствор Na2CO3 (2 моль/дм3).
14. Дистиллированная вода.
|
|
