
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Загрязнение атмосферы соединениями азота
|
|
Из соединений азота в атмосфере присутствуют NO, NO2 (главным образом), N2O, а также HNO3, NH3, ионы 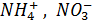 . Уровень концентрации некоторых из этих соединений вблизи поверхности земли характеризуют следующие цифры
. Уровень концентрации некоторых из этих соединений вблизи поверхности земли характеризуют следующие цифры
| Вещество | Концентрация (в пересчете на N), мкг/м3 | |
| загрязненный район | отдаленный район | |
| NO | 5-50 | 0.05-0.5 |
| NO2 | 5-50 | 0.2-2.0 |
| HNO3 | 0.2-2.0 | |
| NH3 | - | 0.1-1.0 |
Величины естественной и антропогенной эмиссии соединений азота в атмосферу сопоставимы (по порядку величин). Источники загрязнения атмосферы соединениями азота следующие:
| источники | поступление в атмосферу (в пересчете на азот) [количество выбросов азота в год] млн.т/год |
| естественные | |
| - почвенная эмиссия (жизнедеятельность микроорганизмов) | |
| - грозовые разряды | |
| - горение биомассы | |
| - прочие | 2-12 |
| антропогенные | |
| - сжигание топлива | |
| - транспорт | |
| - промышленность | |
| ∑ | 51-61 |
Отсюда – сжигание топлива и транспорт в сумме дают > 30% всех ступления азота в атмосферу.
Основные представители соединений азота в атмосфере являются оксиды NO и NO2, а также N2O.
Природное загрязнение атмосферы оксидами азота:
1) связано с электрическими разрядами в атмосфере, при которых образуется NO, окисляясь затем в NO2
(рассматривали: 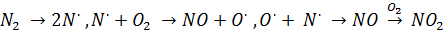 )
)
2) значительная часть оксидов выделяется в результате микробиологических процессов в почвах, богатых азотом (азотсодержащими удобрениями) с плохой воздухопроницаемостью. Благоприятным условием этих процессов является рН > 4, 5. В цепочке превращений (денитрификационных)
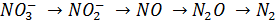
Избыток 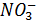 препятствует последнему превращению и обуславливает выделение в атмосферу
препятствует последнему превращению и обуславливает выделение в атмосферу 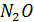 , доля которого достигает 50% от выделенных почвой соединений азота.
, доля которого достигает 50% от выделенных почвой соединений азота.
Антропогенные источники оксидов азота
Из антропогенных источников наибольшая часть NOx поступает от сжигания топлив в стационарно-передвижных установках. Источник, несвязанных со сжиганием топлив, является производство HNO3. Также частично техногенно обусловленным является поступление в атмосферу N2O в результате применения минеральных удобрений.
Но все же главный источник - процессы сжигания.
В реакции горения образованию оксидов азота способствует 2 источника (т.е. участвует 2 формы азота)
- воздух (азот воздуха);
- компоненты топлива, содержащие азот – твердых топлив (уголь) и жидких (газ не содержит азотистых соединений).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
|
 Образование оксидов азота может быть описано 2-мя основными уравнениями (равновесными) окислительных реакций.
Образование оксидов азота может быть описано 2-мя основными уравнениями (равновесными) окислительных реакций.
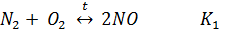
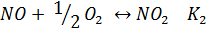
Равновесие этих реакций зависит от температуры противоположным образом.
Значение К1 при температуре ниже 1000К очень мало (< 10-4) при 1500 К составляет примерно 10-3, а при 2000К примерно 10-2. Т.е. при увеличении температуры равновесная концентрация NO возрастает и при Т> 1500К можно ожидать заметного количества NO.
Значение К2 уменьшается с возрастанием температуры – при 500К – 102, а при 1500К – 10-2 , т.е. низкие температуры способствуют образованию NO2, а при высоких он диссоциирует до NO.
Температуры пламени при реакциях горения углеводородов при концентрации воздуха близких к стехиометрическим составляют 1900-2200К, поэтому основным продуктом окисления азота при сжигании топлива является NO – примерно 95% NOx выбрасывается в атмосферу в виде NO.
Исходя из влияния температуры на равновесие при охлаждении продуктов сгорания после передачи ими тепла нагревательным элементам (за пределами зоны горения) можно было бы ожидать снижения концентрации NO и возрастания равновесной концентрации NO2. Но этого не наблюдается вследствие малых скоростей этих реакций при температуре < 1500К (по сравнению со скоростью выноса продуктов горения из ________).
Т.е. сформировавшиеся при более высоких температурах концентрации NOx «замораживаются».
Далее NO в атмосфере преимущественно окисляется до NO2 в соответствии с кинетикой реакции но практически не диссоциирует.
Рассмотренные две реакции дают обобщенное представление о процессе окисления.
Фактически же механизм образования NOx из N2 более сложен. Он является радикально-цепным и включает ряд промежуточных стадий.
Диссоциация O2 (1) O2 ↔ 2O – эта реакция инициирует развитие
цепного процесса
|
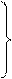 lim стадия ← (2) N2 + O ↔ NO + N
lim стадия ← (2) N2 + O ↔ NO + N
(3) N + O2 ↔ NO + O
(4) N + OH ↔ NO + H
Оксиды азота, образовавшиеся по механизму Зельдовича, называют «термические» исходя из того что NO по данным реакциям образуется лишь при высоких температурах и повышение температуры способствует увеличению выхода термического NO (как и время пребывания в зоне высоких температур).
Из рассмотренных реакций реакция (2) – взаимодействие N2 с O является лимитирующей скорость всего процесса поскольку разрыв связи N≡ N требует наибольших затрат энергии и протекает с наименьшей скоростью.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Помимо температуры и времени на выход термического NO влияет избыток воздуха (по отношению к теоретическому), подаваемого на горение. Влияние избытка воздуха на образование NO отражает следующая кривая зависимости
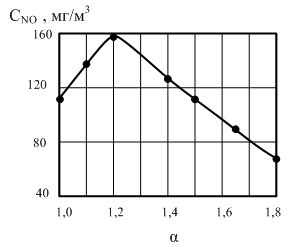
Избыток воздуха принято характеризовать коэффициентом α, при теоретическом количестве α =1, при больших значениях α > 1 горючие смеси называют «бедными» и наоборот.
Кривая имеет максимум при α около 1, 2. В области значений до 1, 2 повышение концентрации О2 в горючей смеси способствует более активному окислению. Но при возрастании α понижается также и температура факела пламени и при некотором (критическом значении) этот фактор становится преобладающим (при α ~1, 2 – далее понижение температуры пламени влияет на образовании NO сильнее, чем увеличение концентрации кислорода)
Реакции по механизму Зельдовича не являются исчерпывающим описанием образования NO при горении. При изучении процессов сжигания топлив было выяснено что фактическая скорость образования NO выше чем та которая следует из механизма Зельдовича.
Оказалось также, что вблизи зоны горения образуется большое количество HСN, который быстро окисляется в NO. Такое ускоренное образование NO было названо «быстрым».
Быстрый NO является результатом взаимодействия N2 с углеводородным радикалом, образующимся на промежуточных стадиях горения, например.
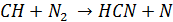
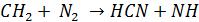
Цианистые соединения далее приводят к образованию аминовых радикалов (ион NH3), который быстро взаимодействует с промежуточным радикалом RO или RN давая NO или N2.
|

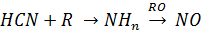
N2
Эти реакции протеквают энергично уже при 1200 – 1600К, когда термический NO практически не образуется.
Доля «быстрях» оксидов азота в суммарном выбросе может составлять от 10 до 50% в установках разной мощности с разной теплонапряженностью в зоне горения.
Топливные оксиды азота образуются при окислении азотсодержащих соединений, входящих в состав твердых и жидких топлив – они значительно легче окисляются до NO, чем азот воздуха вследствие того, что энергия диссоциации связей С-N или N-H в 2-4 раза меньше, чем связей N≡ Т. Превращение азота топлива в NO проходит вже при темпертаре в зоне реакции 950 – 1300К.
Механизм образования топливного NO сложен и до конца не исследован. Но предполагается, что первоначально азотсодержащие компоненты топлива в предпламенной зоне подвергают пиролизу под влиянием высокой температуры. При этом образуются азотсодержащие вещества с маленькой молекулярной массой – NH3, HCN, которые окисляются до NO.
Степень конверсии азота топлива в NO зависит от его содержания в топливе – при очень низком содержании наблюдается почти полная конверсия.
Выход NO из азота топлива слабо зависит от температуры, но очень чувствителен к концентрации кислорода – с возрастанием концентрации с факеле выход NO существенно возрастает.
Опасность загрязнения атмосферы оксидами азота
В чем заключается опасность поступления оксидов азота в атмосферу (это опасность и локального и глобального характера)
а) оксиды азота (NO, NO2) играют ключевую роль в образовании фотохимического смога
б) закись азота (гемиоксид) наряду с фреонами являются разрушителем озонового слоя, поскольку, будучи химически инертными в тропосфере проникает в стратоферу, где приводит к образованию NO
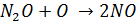 –который, как известно является
–который, как известно является
катализатором разрушения озона
в) кроме того N2O относится к парниковым газам
г) оксиды азота наряду с SO2 приводят к выпадению кислотных дождей образуя в атмосфере азотную кислоту.
В образовании HNO3 основную роль играют гомогенные газофазные реакции, инициируемые радикалами – 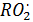 ,
, 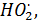 OH (гетерогенные и жидкофазные реакции вносят много меньший вклад):
OH (гетерогенные и жидкофазные реакции вносят много меньший вклад):

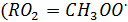 - образующийся при окислении метана)
- образующийся при окислении метана)
|
|
