
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Очень важная в химии атмосферы
|
|
Атомарный кислород в основном состоянии О(3р) выполняет очень важную роль, так как участвует в образовании озона как в стратосфере, так и в тропосфере.
В принципе озон – высокотоксичный газ, его токсичность примерно на порядок выше, чем у SO2. Он к тому же сильнейший окислитель, поэтому в воздухе тропосферы озон представляет высокую опасность для всего живого. Но в стратосфере озон, как отмечалось, выполняет очень важную функцию и снижение его концентрации на этой высоте несет серьезную опасность.
Для характеристики содержания озона в атмосфере используют специальную систему измерения – единицу Добсона (е.Д.). Название это получено от названия спектрометра Добсона, который первоначально применяли для измерения концентрации озона. Спектрометр позволял достаточно точно определить общее содержание озона в столбе воздуха над наблюдателем (над прибором).
Концентрация озона в е.Д. соответствует толщине (высоте) слоя озона, который мог бы образовать весь озон, содержащийся в столбе атмосферы единичной площади при неизменных условиях.
За 1 е.Д. принимают слой озона высотой 10-5м (0, 01 мм). Общее количество озона в атмосфере меняется от 220 до 760 е.Д. (наиболее часто 200-400 е.Д.) при среднем для всего земного шара значении 290 е.Д.
Общее содержание озона над конкретно территорией изменяется в достаточно широких пределах и зависит не только от фотохимических процессов в атмосфере, но и движения воздушных масс. Есть ряд общих закономерностей изменения концентрации озона, связанных со временем года и географической широтой местности. Не вдаваясь в детали можно отметить, что наибольшие изменения концентрации характерны для высоких широт северного полушария (70-800 с.ш.), где среднее содержание озона меняется от 450 е.Д. в марте (конец зимы начало весны) до 280 в сентябре (т.е. min – осенью). В средних (40-450 с.ш.) широтах изменения меньше (от 370 е.Д. весной до 280 е.Д. осенью) В низких широтах (< 300 с.ш.) сезонные колебания практически отсутствуют (< 20 е.Д.).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В южном полушарии картина та же, но менее выраженная.
Озон образуется при взаимодействии атом О(3р) с молекулой О2
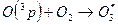 [атомарный О(1Д), взаимодействую с О2 дает
[атомарный О(1Д), взаимодействую с О2 дает 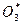 со слишком высокой внутренней энергией, так что молекулу
со слишком высокой внутренней энергией, так что молекулу 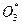 невозможно стабилизировать при участии 3-ей молекулы]
невозможно стабилизировать при участии 3-ей молекулы]
Молекула озона при этом находится в колебательно-возбужденном состоянии и может достаточно легко распадаться на исходные компоненты. Образование стабильной молекулы О3 происходит лишь в результате реакции 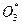 с молекулой О2 или N2, принимающих избыток энергии, и последующего теплового рассеивания энергии возбуждения
с молекулой О2 или N2, принимающих избыток энергии, и последующего теплового рассеивания энергии возбуждения
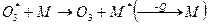
С понижением высоты скорость образования озона определяется двумя факторами:
1) повышением концентрации О2 и N2 (что повышает скорость) и
2) уменьшением интенсивности излучения с l< 240 нм (вызывающего образование атомарного кислорода) – (что снижает скорость)
Сочетание этих двух процессов определяет наличие максимального содержания озона на высоте около 25 км над экватором озон в стратосфере может распадаться:
· взаимодействуя с атомарным кислородом О(3р) он превращается в молекулярный кислород
 (в основном состоянии)
(в основном состоянии)
Или подвергаясь фотодиссоциации в результате поглощения коротковолнового УФ излучения (он сильно поглощает УФ излучение в области 220-310 нм, с max – 255 нм)
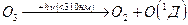 (либо О(3р) в зависимости от энергии поглощенного кванта)
(либо О(3р) в зависимости от энергии поглощенного кванта)
Это важнейший процесс в стратосфере, непосредственно связанный с сохранением жизни на суше (обеспечивающий защиту от УФ излучения).
Эти реакции не приводят к исчезновению озона, поскольку образующийся атомарный кислород О(1Д) (если он образовался при фотодиссоциации) быстро переходит в основное состояние (по рассмотренным реакциям) и вновь участвует в образовании озона. Суммарный процесс образования и разложения озона по приведенным реакциям называется циклом Чепмена:
 - не разделяем на О(1Д) и О(3р) – лимитирующая стадия синтеза О3
- не разделяем на О(1Д) и О(3р) – лимитирующая стадия синтеза О3
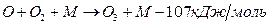 (´ 2 для каждого атома кислорода,
(´ 2 для каждого атома кислорода,
образовавшегося по реакции (1) и
вызывающих данную реакцию)
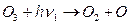
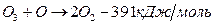 - лимитирующая стадия разрушения озона
- лимитирующая стадия разрушения озона
Сумма этих реакция приводит к нулевому циклу – в нем состав систем не меняется, а поддерживается ее определенное стационарное состояние, причем солнечное излучение УФ-диапазона преобразуется в тепловое:  .
.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Озоновый цикл ответственен за повышение температуры в стратосфере.
Таким образом в стратосфере естественным путем поддерживается стабильная концентрация О3 вследствие динамического равновесия между процессами образования и разложения.
Как отмечалось совокупность процессов образования и разрушения озона, составляющие цикл Чепмена, определяют некоторую среднюю равновесную концентрацию О3 в стратосфере. Однако, прямые измерения концентрации О3 дают значения меньше предсказываемых теорией Чепмена. Причиной этого является присутствие в атмосфере катализаторов разрушения озона, действие которых дополняет реакции цикла Чепмена, приводящие к разрушению озона.
Каталитические циклы разрушения стратосферного озона
Наиболее важными из катализаторов разрушение озона:
· Гидроксильный радикал ОН – наиболее распространенная частица в атмосфере, вызывающая множество разнообразных реакций
· Монооксид азота
· Атомарный хлор
Разрушение озона при участии этих катализаторов происходит следующим образом:
1) Гидроксильный радикал

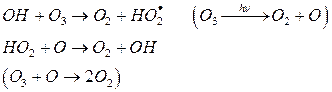
Цикл может разрушиться в результате гибели (рекомбинации) радикалов:
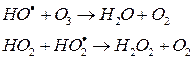
Но до гибели ОН упевает разрушить до 100 молекул О3
2) Монооксид азота

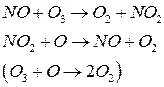
3) Атомарный хлор

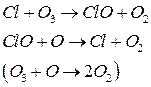
Каждый из катализаторов [в цикле ] регенерируется и вновь вступает в реакции, т.е. развивается циклический процесс, когда 1 частица разрушает большое число молекул О3
ОН, NO, Cl в атмосфере могут появится в результате естественных процессов и в результате антропогенных загрязнений.
Гидроксильный радикал. Их источником являются в основном природные процессы. ОН-радикал
а) является продуктом фотодиссоциации воды
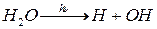
Но этот процесс происходит только в верхних слоях атмосферы, т.к. требуется коротковолновое излучение
б) образуется (как отмечалось) при взаимодействии атомарного O находящегося в возбужденном О(1d), который выделяется при фотолизе О2 в верхних слоях стратосферы при фотолизе О3:
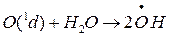 это гораздо более значимый процесс
это гораздо более значимый процесс
в) к образованию ОН приводит еще ряд стратосферных процессов, вносящих несколько меньший вклад:
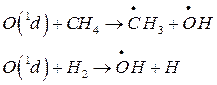
Оксид азота NO
Источники NO в стратосфере преимущественно природные. Главным источником NO считается проникающий в атмосферу оксид N2O. Закись азота образуется на уровне Земли. Она выделяется в атмосферу:
· В результате микробиологической активности в почвах
· При горении биомассы
· При сжигании ископаемого и моторного топлива (в результате высокотемпературного окисления N2 воздуха)
N2O чрезвычайно химически инертен, мало растворим в воде. Таким образом он равномерно распределяется во всей толще тропосферы и имеет продолжительность жизни в тропосфере ~100 лет.. Благодаря инертности, устойчивости он легко проникает (переносится)в стратосферу где:
а) Может претерпевать фотодиссоциацию
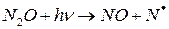
б) Или взаимодействует с ат O(1d):
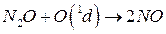 - этот процесс основной, приводящий к образованию NO стратосфере.
- этот процесс основной, приводящий к образованию NO стратосфере.
Кроме того в качестве источника NO рассматривается звуковая высотная авиация – NO содержится в отработавших газах авиационных турбин
В принципе роль NO в химии стратосферного озона – двойная. В нижней части стратосферы (близи термопаузы) NO включается в реакции, аналогичные тем, что протекают у земной поверхности, которые сопровождаются образованием озона.
Но на высоте около 20 км NO включается в цикл разрушения озона.
Атомарный хлор
Главный источник атомарного хлора – антропогенный. Атомарных хлор образуется в результате фотохимического разрушения фреонов (фторхлорметанов или ФХУ), применяющихся в качестве хладоагентов (их др.название хладоны) в холодильных установках, кондиционерах и в качестве пропеллентов (средств для образования аэрозолей) в аэрозольных баллончиках, пенных огнетушителях.
Наиболее широко распространенными фреонами является CF2Cl2 (фреон 12) и CFCl3 (фреон 11). (применительно к производству фреон 12 составляет 85% всей мировой продукции F-содержащих соединений)
В молекулы некоторых фреонов так же включен Br наряду с ат. Cl или вместо него – эти вещества называются галлоны (вместо фреонов), например CF2ClBr – гало 1211, CF3Br – галлон 1301
Фреоны химически инертны и очень устойчивы с нижних слоях атмосферы время их жизни в тропосферы ~ 80 лет, таким образом постепенно они (как и N2O) м.б. перенесены в стратосферу.
В стратосфере (в средних слоях) ХФУ фотохимических разлатапется под действием света с l< 214 нм.
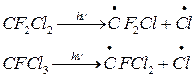
Наряду с фреонами (антропогенного происхождения) в стратосферу спосолен проникать и давать ат Cl природных Cl-содержащий компонент CH3Cl – он выделяется в больших количествах из морской воды, при вулканической дятельности, при горении биомассы (в результате рекомбинации 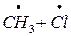 )
)
Потенциальная роль отдельных частиц, участвующих разрушении озона, видна из сравнения значений констант скоростей их реакций с озоном (при одной температуре)
| K, см3/молекул× с | |
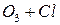
| 8× 10-12 |
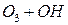
| 6, 7× 10-14 |
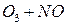
| 2, 5× 10-15 |
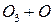
| 5× 10-16 |
Таким образом наиболее активен в этом процессе ат Cl – его константа скорости на 2-3 порядка выше константы скорости других катализаторов.
Систематические наблюдения, проводимые с середины 70-х годов, указывают на существенное изменение в озоновом слое – снижение концентрации озорна. Учитывая отмеченные факты в качестве гл причины рассматривают поступление в стратосферу фреонов.
Образующиеся при фотолизе фреонов атом Cl имеет «сток» из стратосферы (процесс удаления) по реакции с CH4:
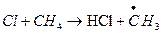
Исследования отмечают увеличение концентрации HCl в стратосфере, что свидетельствует в пользу ведущей роли фреонов в разрушении озона. Реакция Cl с CH4 разрушает «хлорный» цикл, поскольку HCl неактивен по отношению к озону, но он может быть источником активной формы по реакции с гидроксилом:
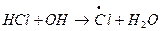
Поэтому HCl относят к так называемым «резервуарным» газам. К образованию «резервуарных» газов приводят и реакции ClO – промежуточная компонента хлорного цикла:
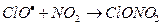 - нитрат оксида хлора
- нитрат оксида хлора
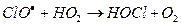
Их фотохимическое разложение генерирует ClO и атомарный хлор – активные к озону частицы.
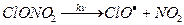
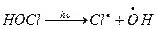
Сходным образом с фреонами ведут себя галлоны – Cl, F, Br, углероды. Они столь же инертны, имеют время жизни в тропосфере примерно 70 лет и могут проникать в стратосферу. Под действием УФ-излучения они разлагаются с выделением Br.
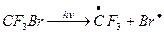
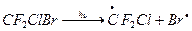
Эти реакции протекают уже в нижней части стратосферы вблизи тропопаузы, таким образом роль атома Br особенно велика в этом слое. Br действует аналогично Cl, разрушая озон в «бромном» цикле, но существенно активнее Cl – один атом Br может разрушить до 100 тыс. молекул озона. Это объясняется малыми скоростями реакции атома Br и BrO, приводящих к неактивным «резервуарным» газам.
Обобщая, можно сделать вывод, что разрушение стратосферного озона происходит с участием различных частиц, предшественниками которых являются и природные компоненты и антропогенные загрязнители. При этом отдельные циклы действуют не изолированно, а испытывают взаимное влияние, например, дезактивация ClO по реакции с NO связывает азотные и хлорные циклы.
Тем не менее, главную опасность, по общему мнению, несут ХФУ. Учитывая это, во многих странах законодательно введены ограничения на использование фторхлорметанов. Это же стимулировало работы по замене ХФУ на вещества с близкими потребительскими свойствами, не представляющими опасность для озона.
В качестве таких заменителей предложены F-Cl углеводороды CHFCl2 (фреон 21), CHF2Cl (фреон 22) и другие. Их отличие от ФХУ заключается в возможности разрушения в тропосфере (тропосферный сток) по реакции с ОН (на примере фреона 22): 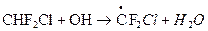
Существование такого стока значительно уменьшает их время жизни в тропосфере и делает их менее опасными для стратосферы. Вместе с тем, тропосферный сток фреонов-заменителей зависит от концентрации ОН, который участвует в реакциях с у/в и с СО. Поэтому увеличение поступления у/в и СО в атмосферу в результате антропогенной деятельности может привести снижению скорости разложения фреонов.
Еще одна проблема разложения F, Cl-углеводородов - образование токсичных веществ в ходе превращения радикалов, образующихся по реакции фреонов с ОН, например:
а) при взаимодействии с молекулярным кислородом
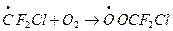 - образование пероксидного радикала
- образование пероксидного радикала
б) его взаимодействие с NO
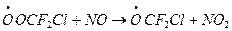
в) образование дифторфосгена – чрезвычайно токсичный и опасный для всех живых организмов, поэтому замена ХФУ F, Cl углеводороды в общем-то не устраняет совсем угрозы озонового слоя и порождает новую экологическую проблему.
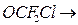 О=СF2
О=СF2
|
|
