
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вода в атмосфере
|
|
Вода циркулирует в природе. Глобальный цикл ее циркуляций включает:
- испарение с водной поверхности, из почвы, с поверхности листьев (транспирация);
- перенос воздушными массами;
- конденсация в виде осадков и выпадение их на земную и водную поверхности;
- образование поверхностного (речного) стока или грунтовых вод (при просачивании внутрь почвы).
В атмосфере вода выполняет 2 функции:
- поддержание теплового баланса (за счет поглощения ИК-излучения) – определяет тепловой режим;
- участвует в процессах миграции и трансформации различных химических веществ
Вода атмосфере присутствует в виде паров. Образование жидкой воды в атмосфере связано с наличием в ней аэрозольных частиц, которые являются центрами конденсации паров. Жидкая вода присутствует в атмосфере главным образом в виде дымки, тумана, облаков, дождя. При этом в дымке вода представляет собой пленку жидкости на поверхности твердой частицы, в других разновидностях она является сплошной средой (каплей разных размеров). Общее у воды в каждом из состояний - сложный химический состав каждой капли (включает растворенные атмосферные газы, органические и неорганические загрязнители атмосферы (растворенные после проникновения и образовавшиеся в результате химических реакций). На поверхности раздела капля-воздух происходит интенсивный массообмен. Под действием солнечного излучения, электрических разрядов в капле могут происходить различные химические превращения главным образом окислительного характера.
Время жизни капель – от нескольких минут (дождевые капли)до 1 часа (капли облаков), в дымке время жизни жидкой воды (капель) может достигать недели. Представление о некоторых характеристиках частиц атмосферы влаги дают следующие данные:
| Водная среда | Размер частиц, мкм | Массовое содержание воды, г/мг | рН | Ионная сила, моль/л | Содержание металлов, моль/л | |
| Fe | Mn | |||||
| Дымка | 0, 03-0, 3 | 10-5-10-4 | 1-8 | 10-4 - 10-3 | 10-7 – 10-4 | |
| Туман | 0, 02-0, 2 | 2-6 | 10-3 - 10-2 | 10-6 - 10-4 | 10-7 – 10-5 | |
| Облака | 0, 1-3 | 3-6 | 10-3 - 10-2 | 10-7 - 10-4 | 10-8 -10-5 | |
| Дождь | 200-2000 | 0, 1-1 | 4-5 | 10-4 | 10-8 - 10-5 | 10-8 - 10-6 |
(Fe и Mn потенциальные катализаторы окислительно-восстановительных превращений) в атмосфере.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Дымка в силу гетерогенного характера частиц включает бОльшее количество примесей металлов и характеризуется более широким интервалом рН.
Многие атмосферные процессы протекают именно в атмосферной влаге (а не только в газовой фазе). Это связано с тем, что жидкофазные реакции особенно характерны для веществ хорошо растворимы в воде. Главным образом это отностися к тем веществам, которые при растворении образуют другие химические формы, например SO2, NO2. Их растворимость повышается вследствие химической реакции с водой и диссоциации образующихся кислот:
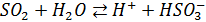
аналогично 
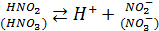
это же касается аммиака:
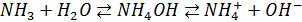
Таким образом с осадками на земную поверхность поступают S и N в форме кислот, сульфатов, нитратов (аммония).
В атмосферной влаге растворяется также и CO2 – кислотный окисел, также образующий в воде кислоту. Поэтому даже если атмосфера не загрязнена никакими другими кислотными окислами (ни SO2, ни NO2), выпавший дождь всегда имеет кислую реакцию (как впрочем и дистиллированная вода, контактирующая с воздухом).
|
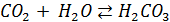 –
–
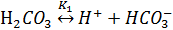
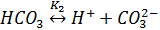
Константа равновесия К1 определяется как
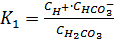 Её величина = 4, 3*10-7 (K2 ~ 10-10)
Её величина = 4, 3*10-7 (K2 ~ 10-10)
Поскольку 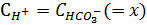 , то выражение для K1 можно записать
, то выражение для K1 можно записать
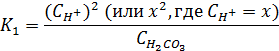
Откуда 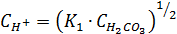 – концентрация H+ в дождевой воде.
– концентрация H+ в дождевой воде.
Концентрация H2CO3 по первой равновесной реакции, равновесие которой выражается константой Генри:
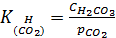 – это справочная величина, для CO2 при 250
– это справочная величина, для CO2 при 250
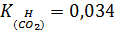 моль/л*атм
моль/л*атм
Откуда 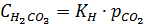
При концентрации CO2 в атмосферном воздухе 0, 035% (об.) его парциальное давление 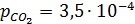 (0, 035: 100).
(0, 035: 100).
Тогда 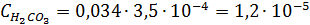 моль/л
моль/л
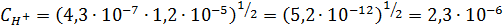 моль/л
моль/л
Откуда 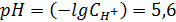
В водной фазе атмосферы протекают также окислительные процессы, в которых большую роль играет H2O2, а также органические пероксиды (RHO2) и перкислоты (RCO3H) – промежуточные продукты окислительных процессов углеводородов (но главные окислитель H2O2).
H2O2 в атмосфере образуется в результате рекомбинации пероксидных радикалов:
HO2+HO2→ O2+H2O2
Пероксид водорода неплохо растворим в воде - в дожде его содержание в среднем около 10-5 моль/л. В присутствии ионов Fe и Mn (типичные примеси в атмосфере) H2O2 может участвовать в жидкофазном окислении расворенного SO2:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
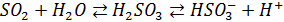
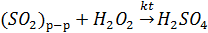
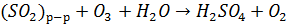
Эта реакция - одна из основных причин выпадения кислотных дождей. На процесс окисления SO2 в жидкой фазе существенное влияние оказывает рН внутри среды капли, поскольку определяет растворимость SO2 и соотношение молекулярно и ионной форм. При низких значения рН снижается и растворимость SO2 и диссоциация H2SO3 при увеличении рН равновесие 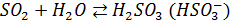 , сдвигается увеличение концентрации
, сдвигается увеличение концентрации 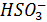 . Способствует образованию
. Способствует образованию 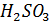 присутствие в атмосфере оксидов щелочно-земельных металлов (например СаО – компоненты летучей золы выбрасываемых ТЭС)
присутствие в атмосфере оксидов щелочно-земельных металлов (например СаО – компоненты летучей золы выбрасываемых ТЭС)
В водной фазе атмсоферы присутствуют также свободные радикалы – пероксидный HO2 и гидроксильный OH. Источником OH радикалов в каплях облаков является реакция радикала HO2 с растворенным в воде озоном:
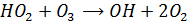
Эта реакция приводит к разрушению озона в тропосфере при облачности (когда озон растворяется в каплях воды в облаках) разрушение в отсутствии облаков в сочетании с NOx
|
|
