
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция №26
|
|





Используя  и
и  найдем уравнение линии инверсии в координатах
найдем уравнение линии инверсии в координатах  и
и  :
:









......

 -уравнение линии инверсии
-уравнение линии инверсии

Рисунок 167. Кривая инверсии.
т.А: 


т.Б: 





Результаты расчетов температурных инверсий по уравнению Ван-дер-Ваальса
для основных газов.
| Газ | N2 | Ar | Воздух | H2 | He | O2 | Ne |

| 126, 26 | 150, 7 |  133 133
| 33, 2 | 5, 2 | 154, 8 | 44, 45 |
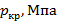
| 3, 398 | 4, 86 | 3, 769 | 1, 28 | 0, 227 | 5, 11 | 2, 721 |
 , К , К
| 820, 07 | 978, 9 | 863, 8 | 33, 8 | 288, 71 | ||
 , К , К
| 105, 84 | 126, 3 | 117, 5 | 27, 7 | 4, 36 | 130, 0 | 37, 26 |
 , МПа , МПа
| 30, 58 | 43, 78 | 33, 9 | 11, 7 | 2, 03 | 46, 0 | 24, 5 |
Введение в низкотемпературное разделение газовых смесей методом ректификации.
Все низкотемпературные газы за исключением гелия получаются из воздуха.
При рассмотрении воздуха как газовой смеси используется бинарная модель N2- О2, либо тройная N2- О2-Ar.
При рассмотрении N2- О2, Ar присоединяют к азоту. В дальнейшем при извлечении других компонентов воздуха также рассматривают бинарные и тройные смеси.
Например, получившийся N2 как смесь N2- Ne, а для получения Ne – смесь Ne-He.

Рисунок 168. Схема ВРУ.
Рассмотрим только бинарную смесь. Состав газовой смеси будем выражать в мольных долях:

Бинарная смесь: 
В смеси жидкостей также используют мольные доли.

Бинарная смесь: 
Кривая упругости компонентов бинарной смеси  зависимость p(T).
зависимость p(T).

Рисунок 169. Кривая упругости компонентов бинарной смеси в pT координатах.
Поскольку при одинаковом давлении первый компонент имеет более низкую температуру кипения, то его называют низкокипящим компонентом смеси, а второй – высококипящим компонентом.
При одинаковой температуре высококипящий компонент имеет более низкое давление, а низкокипящий - более высокое.
Разность давлений является основной движущей силой стремления перейти компоненту из жидкого состояния в парообразное и наоборот. В этом свойстве заключена применимость метода низкотемпературной ректификации для разделения газовых смесей.
Характеристикой разделения бинарных газовых смесей является коэффициент летучести равный отношению давлений низкокипящего компонента к давлению высококипящего компонента при одинаковой температуре:

Если  то данную смесь разделить методом низкотемпературной ректификации невозможно. Чем больше
то данную смесь разделить методом низкотемпературной ректификации невозможно. Чем больше  , тем легче разделить смесь.
, тем легче разделить смесь.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Условие фазового равновесия.
Обычно определяется T, p и m.
Изменение массы m возможно только в случае нарушения фазового равновесия.

Рисунок 170. Иллюстрация равновесия пар-жидкость.
Изменение массы пара  массы жидкости
массы жидкости 
При фазовом равновесии необходимо выполнение следующих условий:
1) давление пара равно давлению жидкости:

2) 
3) 
При нарушении любого из этих условий начнется переход к неравновесному состоянию. Поэтому при рассмотрении процессов разделения газовых смесей методом температурной ректификации необходимо знать условие фазового равновесия и причины, которые вывели систему из этого состояния. Удельный поток вещества определяется по следующей формуле при переходе из одной фазы в другую:
 - коэффициент пропорциональности.
- коэффициент пропорциональности.
Перенос массы между фазами будет происходить в направлении туда, где  будет больше, из фазы, где
будет больше, из фазы, где  будет меньше, т.е. в нашем случае будет переход из пара в жидкость.
будет меньше, т.е. в нашем случае будет переход из пара в жидкость.
Изменение массы  определяется как давлением и температурой, так и содержанием компонента смеси в данной фазе.
определяется как давлением и температурой, так и содержанием компонента смеси в данной фазе.


Изменение массы  иногда называют химическим потенциалом. Последние два уравнения позволяют определить хим. потенциал при условии известности всех переменных, что обычно сделать очень трудно, поэтому вместо разности химических потенциалов рассматривают величины с ним связанные, а именно концентрации или мольные доли.
иногда называют химическим потенциалом. Последние два уравнения позволяют определить хим. потенциал при условии известности всех переменных, что обычно сделать очень трудно, поэтому вместо разности химических потенциалов рассматривают величины с ним связанные, а именно концентрации или мольные доли.
|
|
