
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
МОДУЛЬ №1
|
|
«Амінокислоти. Білки. Нуклеїнові кислоти»
Лекція 1
Вступ
[ 1.с. 8-25; 2. с. 3-15; 4. с. 21-23 ]
План
1 Предмет і задачі біохімії.
2.Місце біохімії серед інших дисциплін, історія розвитку.
3.Основні поняття: асиміляція, дисиміляція, обмін речовин і енергії.
Біологічна хімія, або біохімія, - наука про хімічний склад живих організмів та хімічні процеси, що відбуваються в живих організмах і є основою їх життєдіяльності.
Отже, біохімія вивчає природу речовин, з яких побудований живий організм, їхні перетворення і закономірності цих перетворень залежно від діяльності органів і тканин.
Основне завдання біохімії - вивчити процеси життєдіяльності, а також способи обміну речовин і енергії в організмі, що має важливе теоретичне і практичне значення.
Біохімія як самостійна наука сформувалася лише в другій половині XIXст. Цьому сприяли значні успіхи у вивченні хімічного складу і будови багатьох природних сполук та успіхи фізіології в дослідженні процесів, що відбуваються в живих організмах. Одержані на той час дані були тим фактичним матеріалом, який став основою нової науки –біохімії.
У процесі становлення і розвитку біохімії, як окремої галузі науки, виникли і успішно розвиваються основні її напрямки: статична, динамічна і функціональна біохімія. Статична- досліджує хімічну природу і властивості речовин, що входять до складу організму. Динамічна - вивчає перетворення речовин в організмі і пов’язане з ним перетворення енергії, тобто обмін речовин і енергії в організмі. Функціональна біохімія займається вивченням хімічних процесів, які є основою функціональної діяльності різних органів і систем.
Залежно від об’єкту досліджень розрізняють біохімію людини (медична біохімія), тварин, рослин, мікробів, вірусів та загальну біохімію, яка вивчає вміст і перетворення речовин для живої матерії в цілому.
Обмін речовин складається з фізіологічних (травлення, всмоктування, виділення) і фізичних (сорбція, дифузія, осмос), хімічних (окислення, відновлення, гідроліз, фосфороліз) процесів, які здійснюються при проміжному та внутрішньоклітинному обміні.
Обмін речовин і енергії є однією з найважливіших і найсуттєвіших ознак живого організму. Особливе місце в обміні речовин належить хімічним перетворенням органічних сполук, різноманітність яких зводиться до двох основних реакцій - синтезу і розщеплення - асиміляції і дисиміляції.
Асиміляція - це частина загального обміну, що супроводжується поглинанням органічних сполук з навколишнього середовища, засвоєнням, перетворенням та синтезом за їх рахунок різних структур організму. Цей процес включає численні хімічні реакції та перетворення органічних сполук, які забезпечують використання організмом поживних речовин, що потрапляють з навколишнього середовища. За рахунок цього забезпечуються процеси росту, розвитку, самооновлення організму. Асиміляція супроводжується анаболітичними реакціями, які забезпечують синтез складних органічних сполук. Вони супроводжуються використанням енергії - є ендерголічними.
Дисиміляція - це частина загального обміну, в процесі якого відбувається руйнування та розщеплення складних органічних сполук, які потрапляють з продуктами харчування, та тих, що входять до складу власних структур організму –білків, вуглеводів, ліпідів з утворенням простіших сполук та кінцевих продуктів обміну. Для дисиміляції характерні катаболітичні реакції, які супроводжуються виділенням енергії, тобто є екзергонічними.
Обмін речовин в організмі тісно пов’язаний з обміном енергії. За рахунок надходження енергії забезпечується підтримання стабільного, впорядкованого стану живої системи. Енергія необхідна організму для забезпечення таких процесів: виконання різної роботи (механічної, осмотичної, фізичної); руху, скорочення та розслаблення м’язів; синтезу та розщеплення різних сполук; транспорту речовин та іонів; підтримання гомеостазу; виконання специфічних функцій, що забезпечують процеси життєдіяльності.
Залежно від способу вилучення енергії всі живі організми поділяють на фото і хемотрофи. Фототрофи у вигляді джерела енергії використовують енергію квантів світла. До них належать рослини, водорості, деякі бактерії. Дані організми синтезують складні органічні сполуки з неорганічних за рахунок сонячного випромінювання. За типом живлення вони належать до автотрофних. Хемотрофні організми у вигляді джерела енергії використовують енергію окислення органічних чи неорганічних сполук. За типом живлення вони є гетеротрофами. До них належать організми людини, тварин та деякі мікроорганізми.
Лекція 2
Амінокислоти
[ 1.с. 34-46; 2. с. 48-65; 3. с. 284; 4. с. 35-43 ]
План
1.Класифікація амінокислот
2.Характеристика амінокислот
3. Основні способи добування амінокислот
Природні білки складаються з 20 амінокислот, які можуть сполучатися в різній послідовності й утворювати величезну кількість різних білків. Теоретично можливо з 20 амінокислот отримати 24· 1018 різноманітних білків - ізомерів. Насправді існує значно менше білків, оскільки послідовність амінокислот у молекулі білка закодована в молекулі ДНК.
Амінокислоти, виділені з білків, називають протеїногенними. Вони входять до складу природних білків і мають загальну хімічну структуру:
R

 H2N— α C— H
H2N— α C— H
COOH
Природні амінокислоти є α -амінокислоти, оскілки аміногрупи (–NH2), йон Гідрогену та боковий радикал сполучені з атомом Карбону, що знаходяться в α - положенні відносно карбоксильної групи. Усі α - амінокислоти, крім гліцину, містять асиметричний атом Карбону (сполучений з чотирма різними функціональними групами) і є оптично активними речовинами, тобто здатні обертати площину поляризації світла. Отже, природні амінокислоти є стереоізомерами L-ряду:






CH3 CH3



H—C—NH2 NH2—C—H

COOH COOH
D-Аланін L-Аланін
D-Амінокислоти трапляються лише в найпростіших організмах – бактеріях, грибах, водоростях – та входять до складу деяких антибіотиків. Оптичні ізомери амінокислот розрізняють за смаком (L- гіркі або без смаку, D-солодкі).
У водному середовищі амінокислоти перебувають переважно в йонній формі. У нейтральному середовищі (pH=7)вони являють собою нейтральний біполярний йон (цвітер - йон), у кислому – позитивно заряджений йон (катіон), у лужному – негативно заряджений йон (аніон):

Сумарний заряд молекул амінокислот визначається співвідношенням кількості вільних кислотних або основних груп, ступенем їх дисоціації, рН середовища. При рівності позитивних і негативних зарядів молекула амінокислоти перебуває в ізоелектричному стані.
Характерне для кожної амінокислоти значення рН середовища, при якому амінокислота має сумарний нульовий заряд називається ізоелектричною точкою.
Отже, амінокислоти є амфотерними електролітами.
Хімічною властивістю α - амінокислот є здатність утворювати пептиди- сполуки, що складаються з амінокислотних залишків з великою молекулярною масою(менше 5-6 кДа). Білки мають молекулярну масу від 5-6 до 50 кДа, тому і відрізняються фізико-хімічними властивостями, вони складаються з декількох пептидних ланцюгів.
За значенням для організму розрізняють:
· Незамінні амінокислоти, які в організмі людини не синтезуються, а мають надходити з їжею (фенілаланін, триптофан, лейцин, ізолейцин, валін, лізин, метіонін, треонін);
· Напівзамінні амінокислоти, які синтезуються в організмі людини, але в недостатній кількості, тому повинні надходити з їжею (аргінін, тирозин, гістидин);
· Замінні амінокислоти, які синтезуються в організмі людини з інших сполук (гліцин, аланін, серин, цистеїн, глутамін, аспарагін, пролін, аспарагінова кислота, глутамінова кислота).
За хімічною будовою амінокислоти поділяють на циклічні і ациклічні. Ациклічні залежно від кількості аміно- та карбоксильних груп поділяють на:
· моноаміномонокарбонові (містять одну аміногрупу й одну карбоксильну групу, виявляють амфотерні властивості);
· діаміномонокарбонові (містять дві аміногрупи й одну карбоксильну групу, переважають основні властивості);
· моноамінодикарбонові (містять одну аміногрупу й дві карбоксильні групи, переважають кислотні властивості);
· діамінодікарбонові (містять дві аміногрупи й дві карбоксильні групи).
Залежно від полярності та заряду радикала всі амінокислоти поділяють на:
· неполярні, або гідрофобні;
· полярні (гідрофільні), але незаряджені;
· полярні позитивно заряджені;
· полярні негативно заряджені.
Основні способи добування амінокислот
Вільних амінокислот у природі дуже мало. Добувають амінокислоти гідролізом білків, а також хімічним і мікробіологічним синтезом. Розрізняють три види гідролізу білків – кислотний, лужний, ферментативний. У лабораторних і заводських умовах найчастіше використовують кислотний гідроліз. Окремі амінокислоти з гідролізату виділяють різними методами: осадженням, розділенням на спеціальних смолах, а також методами електрофорезу і хроматографії. Гідролізом можна добути амінокислоти, що входять до складу білків у значних кількостях. Таким способом виділяють гліцин з желатину, глютамінову кислоту з казеїну, клейковину зі злаків, тирозин з фіброїну шовку, цистин і цистеїн з шерсті, гістидин з білків крові. Однак відносно висока собівартість, дефіцитність вихідної сировини, її багатоступенева хімічна обробка не дає поки що можливості широко використовувати цей спосіб у промисловості. Разом з цим кислотний гідроліз часто супроводжується руйнуванням деяких амінокислот, гідроліз може бути неповним.
Для одержання амінокислот широко використовують методи хімічного синтезу. Основним недоліком методу є утворення рацемічних форм амінокислот(за винятком гліцину), тоді як в організмах людини і тварин використовуються L-амінокислоти (виняток- метіонін).
Тому найбільш рентабельно і економічно вигідно добувати амінокислоти мікробіологічним способом, тому що він не має недоліків хімічного синтезу.
Лекція 3
Білки
[ 1.с. 31-34 с. 50-82; 2. с. 65-133; 3. с. 302-320; 4. с. 34-35; 43-59 ]
План
1.Хімічний склад білків
2.Функції білків в організмі
3.Характеристика амінокислот
4.Будова і структура білків
5.Фізико-хімічні властивості білків
6.Класифікація та характеристика окремих груп білків
Білки- високомолекулярні сполуки, які складаються з великої кількості низькомолекулярних сполук – залишків амінокислот.
У результаті хімічного аналізу білків було визначено їх важливі складові елементи та кількісне співвідношення. До складу білків входять, %: вуглець-50-55, водень- 6, 5-7, 3, азот- 15-17, кисень- 21-23, сірка- 0, 3-2, 5. У складі білків було виявлено також фосфор, йод, залізо, та інші елементи.
Оскільки у складі різних білків найбільш стабільним є вміст азоту (16%), то за його кількістю почали визначати вміст білків у тканинах органів, рідинах, препаратах. Для цього одержану в результаті аналізу кількість азоту множать на коефіцієнт 6, 25(100: 16=6, 25).
Білки в організмі виконують найрізноманітніші функції.
Структурна функція. Білки в середньому становлять 18-21% загальної сирої маси організму людини і тварин і до 45-50% їх сухої маси. Вони входять до складу всіх органів і тканин. Вони беруть участь в утворенні структурної основи клітин і їх органел.
Каталітична функція. Ферменти- біологічні каталізатори, що зумовлюють перебіг хімічних реакцій в організмі-мають білкову природу.
Гормональна функція. Значна кількість гормонів є білками або продуктами білкового обміну. Вони беруть активну участь у регуляції обміну, впливають на проникність клітинних мембран, регулюють активність ферментів.
Транспортна функція. Для нормальної життєдіяльності кожного організму необхідне постійне забезпечення його органів і тканин поживними речовинами. Вони переносяться з током крові сполуками білкової природи(перенесення кисню і вуглекислого газу за допомогою гемоглобіну, транспорт ліпідів, жиророзчинних вітамінів за участю ліпопротеїдів).
Захисна функція здійснюється за участю білків γ - глобулінів, з якими пов’язані імунні реакції організму. Антитіла, що утворюються в організмі при несприятливій дії на нього різних факторів, мають білкову природу. Захисна функція полягає і в участі білків в процесах зсідання крові.
Механічна функція. Білки беруть участь у забезпеченні різних форм механічного руху- скороченні і розслабленні м’язів, роботі внутрішніх органів.
Енергетична функція. Білки є важливим джерелом енергії для організму. При розщепленні 1 г білка вивільняється 17, 7 кДж енергії. За рахунок білків організм людини одержує 10-15% енергії.
Природні білки складаються з 20 амінокислот. Близько 10 амінокислот зустрічається у білках досить рідко. Всі амінокислоти, що входять до складу білків, називають протеїногенними. Решта входить до складу фізіологічно активних речовин (гормонів, коферментів, антибіотиків) або знаходяться в органах та тканинах тварин і рослин у вільному стані- непротеїногенні.
Незамінні амінокислоти - це такі, які в організмі не синтезуються. Тому вони повинні поступати в організм ззовні, з їжею. До них відносять: валін, лейцин, ізолейцин, треонін, лізин, метіонін, фенілаланін і триптофан.
До напівнезамінних належать ті, що синтезуються в організмі в недостатній кількості: аргінін, тирозин, гістидин.
Замінні синтезуються в організмі з цілого ряду органічних сполук, в тому числі з деяких амінокислот.
Розрізняють чотири рівні структурної організації білків: первинна, вторинна, третинна і четвертинна.
Первинна - це лінійний ланцюг амінокислот, які розміщені у певній послідовності і сполучені пептидними зв’язками. Пептидний зв'язок утворюється карбоксильною й амінною групами сусідніх амінокислот. У поліпептидному ланцюзі є залишок амінокислоти, що має вільну
α - аміногрупу (N- кінцева амінокислота), та залишок амінокислоти, що має вільну α -карбоксильну групу (С- кінцева амінокислота). Нумерацію амінокислотних залишків, які визначають первинну структуру білків, починають з N- кінцевої амінокислоти.
Вторинна –це впорядковане розташування в просторі поліпептидного ланцюга. Виділяють α -спіральну конфігурацію і β - складчасту структуру.
α -Спіральна конфігурація утворюється зкручуванням поліпептидного ланцюга і стабілізується водневими зв’язками, які утворюються між –С=О- та –NH-групами амінокислот, що утворюють пептидні зв’язки і віддалені одна від одної на чотири амінокислотних залишки. На один оберт спіралі припадає 3, 6 амінокислотного залишка, радикали яких направлені на поверхню і відхилені в сторону, водневі зв’язки спрямовані паралельно осі молекули.
β - структура – на зразок складчастого шару, який складається з двох або більше розміщених поряд поліпептидних ланцюгів і стабілізується водневими зв’язками, що сполучають групи –С=О та –NH– сусідніх ланцюгів.
Третинна – це спосіб розміщення в просторі поліпептидного ланцюга з певною вторинною структурою. Завдяки гідрофобним взаємодіям гнучкий білковий ланцюг звертається в клубок. За формою третинної структури розрізняють глобулярні і фібрилярні білки. Глобулярні – кулеподібної або еліпсоїдної форми (альбуміни плазми крові, гемоглобін, більшість ферментів), а фібрилярні- довгастої форми (колаген, еластин, кератин). Гідрофобні зв’язки виникають між неполярними радикалами у внутрішній (гідрофобній) частині молекули, а полярні (гідрофільні) радикали містяться на поверхні глобули в гідратованому стані.
Четвертинна - утворюється при обєднанні кількох поліпептидних ланцюгів з первинною, вторинною, третинною структурою. Ця структура характерна для білків, які побудовані з двох і більше індивідуальних поліпептидних ланцюгів. Такі ланцюги називаються субодиницями (протомірами), вони утворюють єдиний агрегат. Молекула складається з чотирьох попарно зв’язаних одна з одною субодиниць. Четвертинна структура стабілізується гідрофобними, водневими, та йонними зв’язками, які у разі незначної зміни третинної структури білка або під впливом факторів середовища(рН, температури, йонної сили) дисоціюють, що призводить до руйнування четвертинної структури білка і втрати його функціональної активності. Прикладом є гемоглобін (білок еритроцитів, який транспортує кисень). Молекула гемоглобіну складається з чотирьох субодиниць- двох α - і двох β -поліпептидних ланцюгів, кожен з яких зв’язаний з небілковою сполукою-гемом.
Типи зв’язку в білкових молекулах
Ковалентний - 1-1- пептидний, 1-2-дисульфідний(утворюється між залишками молекули цистеїну, які входять в один або різні пептидні ланцюги).
Нековалентні зв’язки і слабкі взаємодії – 2-1- водневий зв'язок. Виникає між електронегативним атомом і  . В білках вони утворюються між Воднем груп =NH іміногрупа, -ОН, -SH і сусіднім атомом Кисню.
. В білках вони утворюються між Воднем груп =NH іміногрупа, -ОН, -SH і сусіднім атомом Кисню.
Йонні –зв’язують між собою іонізовані амінні і карбоксильні групи
2-3-дипольні зв’язки – електростатичні зв’язки між радикалами полярних амінокислот (серина, треоніна).
2-4-гідрофобні взаємодії –слабкі взаємодії, що виникають між радикалами таких амінокислот як валін, лейцин, ізолейцин та інших неполярних амінокислот за рахунок їх виштовхування з полярної фази.
Фізико-хімічні властивості білків
Білки -амфотерні електроліти, які в кислому середовищі дисоціюють як луги, в лужному –як кислоти.
Фізичні:
· рухомість молекул в електричному полі
· оптична активність
· здатність розсіювати світло(значний розмір білкової частини)
· здатність поглинати ультрафіолетові промені
· здатність адсорбувати низькомолекулярні органічні сполуки і іони(з цією властивістю пов’язана транспортна функція в організмі)
· білки знаходяться в колоїдному стані.
Перелічені властивості використовуються при їх фракціонуванні, кількісному визначенні, вимірі молекулярної маси.
· білки- амфотерні електроліти(здатні утворювати солеподібні сполуки з H+ і OH-)
· в’язкість, здатність до набухання- залежить від ступеня дисоції білків
· амфотерні властивості обумовлені їх значенням як буферна система, що підтримує сталість середовища в тканинах.
Як і для амінокислот для білків існує поняття ізоелектричної точки.
Гідрофільність - здатність утворювати навколо глобул гідратної оболонки в результаті протягування молекул води до дисоційованих функціональних груп білка.
Коагуляція - зближення і склеювання колоїдних частинок.
Необернена - відбувається при дії високих температур, солей важких металів- їх іони утворюють нерозчинні в воді комплекси.
Обернена (висолювання)- під впливом солей лужних металів іони будують свої гідратні оболонки за рахунок руйнування таких же оболонок в молекулі білка. Цьому також сприяє адсорбція іонів солей на заряджених молекулах білка. При розбавленні коагульованих розчинів білка водою білок знову переходить в розчинний стан.
Денатурація - порушення в білках специфічної макроструктури і перетворення біологічно активної речовини. Білок при денатурації втрачає нативні специфічні властивості і набуває нових, не характерних для даного білка.
При певних умовах денатурований білок частково або повністю можна повернути до початкового стану - ренатурація.
Механізм впливу денатуруючих реагентів полягає в руйнуванні зв’язків зі стабілізуючою системою.
До фізичних факторів відносять: температуру більше 60º С-інактивування ферментів, підвищення тиску, замороження, ультразвук.
До хімічних - рН менше 4, рН більше 10, органічні розчинники(спирт, ацетон), солі важких металів.
Класифікація
В основі класифікації лежить декілька ознак:
· форма молекул білка (глобулярні, фібрилярні)
· фізико- хімічні властивості
· хімічний склад білків
· за походженням
За фізико- хімічними властивостями діляться на:
Прості (протеїни)- при гідролізі розпадаються на виключно амінокислоти.
Складні (протеїди)- при гідролізі разом з амінокислотами утворюють й інші речовини (вуглеводи, нуклеїнові кислоти, фосфорна кислота, ліпіди та ін.- називаються простетичною групою).
Лекція №4
Білки харчової сировини
[ 1.с. 83-97 ]
План
1. Білки м’яса.
2. Білки субпродуктів.
3. Білки яєць сільськогосподарської птиці.
4. Білки молока.
Білки м'яса
Білки м'язової тканини повчоцінні за своїм складом, легко перетравлюються і засвоюються організмом. Біологічна цінність м’яса залежить не тільки від складу м’язових білків, але й від наявності сполучної тканини і жиру. Більш високий вміст двох останніх компонентів знижує біологічну цінність м’яса. Білки м’язової тканини виконують скорочувальну функцію, а білки сполучної тканини і хрящової - опорну функцію.
Білки м’язів мають фібрилярну (ниткоподібну) структуру. Вміст білка в м’ясних продуктах коливається в межах від 11 до 22%.
Головними м’язовими білками є міозин і актин. Вони беруть участь у м’язовому скороченні і розслабленні за участі АТФ.
Крім того, у м’язових клітинах міститься міоглобін, що накопичує Оксиген у м’язах. Він є глобулярним (у вигляді кульки) хромопротеїном. В умовах кисневого голодування Оксиген відщеплюється від міоглобіну, надходить у мітохондри м’язових кліток, де відбувається синтез АТФ.
Ферум у міоглобіні двовалентний (оксиміоглобін). Яскраво- червоне забарвлення м’ясних продуктів залежить від міоглобіну й оксиміоглобіну. При окиснюванні міоглобіну утворюється червоно-коричневий метміоглобін. Він втрачає здатність зв’язувати Оксиген (ферум тривалентний). При тепловому впливі міоглобін також втрачає здатність зв'язувати Оксиген. При цьому змінюється колір виробів (коричневий).
У м’ясі міститься колаген. Особливо багато його в хрящовій тканині, шкірі, сухожиллях, хрящах, кістках, рогівці ока.
У колагені багато оксипроліну, оксилізинну. За кількістю оксипроліну визначають ступінь розвареності колагену при оцінці якості м’яса.
Близьким за складом до колагену с білок еластин. Він міститься в сухожиллях і стінках кровоносних судин. Еластин багатий на такі амінокислоти, як гліцин, аланін, лізин, але бідний на пролін. М’ясо, багате на сполучну тканину, залишається твердим після теплової обробки, через що засвоюваність колагену й еластину є низькою.
За тривалої термічної обробки з колагену утвор: осться желатин. Він є неповноцінним білком, тому що в його складі відсутньо, багато амінокислот.
Білки субпродуктів
Субпродуктами називають другорядні продукти забою тварин: внутрішні органи, голови, хвости, нижні частини кінцівок, губи, вуха, м’ясну обрізь.
Білки субпродуктів відрізняються від білків м’яса за амінокислотним складом, вмістом сполучної тканини, здатністю перетравлюватися ферментами шлунково-кишкового тракту. За складом субпродукти поділяють на три групи:
1) паренхіматозні органи (печінка, легені, нирки, головний мозок, вим’я, селезінка); остів цих органів складається з колагену;
2) серце, язик, діафрагма, шлунок - до їх складу входять сполучна і м’язова тканини;
3) голови, ноги, губи, вуха, хвости будова яких наближається до складу м’язової, сполучної і жирової тканин; унаслідок цього розрізняють субпродукти: м’ясо-кісткові, м’язові, м’якотні шерстисті (вуха, губи), слизові.
Субпродукти містять значну кількість білків, але за своєю повноцінністю вони відрізняються. Зокрема, вміст неповноцінних білків у печінці - менш ніж 10%, у яловичих легенях - близько 60%, у яловичих губах - 75%.
М’ясна обрізь незначною мірою відрізняється від м’яса. Вміст білка в ній становить 18, 9% (яловича обрізь), кількість колагену - близько 4%. За амінокислотним складом білки обрізі наближаються до м’яса (але містять мало триптофану).
У серці багато гемоглобіну, а за іншими показниками білковий склад його не відрізняється від м’яса.
Язик з а складом близький до м’яса.
Головний мозок містить мало білків. Здебільшого це альбуміни, глобуліни, ліпопротеіни, нуклеопротеїни.
Легені відрізняються високим вмістом колагену. У них мало повноцінних білків.
Вміст білків у печінці коливається від 17 до 19%. Вона багата на глобуліни й альбуміни, хромопротеїни і феритин (він є постачальником заліза в організмі). Крім того, у печінці містяться нуклеопротеїни, глікопротеїни, колаген і еластин. Білки печінки добре перетравлюються.
Білки яєць сільскогосподарської птиці
Яйця широко використовуються як окремий продукт, а також у різних технологічних процесах готування їжі. Високі функціональні та технологічні властивості, а також харчова цінність яєць дозволяють їх використовувати і як активний компонент технологічного процесу, і як рецептурний компонент їжі. Більшість властивостей яєць обумовлена унікальними особливостями їх білків.
Протеїни містяться в кожній частині яйця в різному стані. У білку яйця близько 50% протеїнів знаходяться в розчиненому стані, у жовтку 44% - у вигляді комплексних сполук з ліпідами. У жовтку яєць в оптимальних кількостях містяться ововітелін та оволіветин.
фору яєць.
Ововітелін - фосфопротеїд, що містить ще 1/3 усього фосфору яєць
Оволіветин - фосфопротеїд, але містить ще 1/3 усього сульфуру яєць.
У менших кількостях у жовтку містяться фосфіткн та овові- теломукоїд. Протеїни білка предстаалені овоальбуміном, овому- коїдом, овомуцином, овоглобуліном.
Білки молока
Молоко - полідисперсна система. Молоко і продукти його переробки є цінною сировиною і напівфабрикатами. Їхня висока біологічна цінність обумовлена оптимальним вмістом і майже ідеальним співвідношенням білків, ліпідів, вуглеводів, мінеральних солей і вітамінів. Завдяки складу і збалансованості амінокислот ці речовини засвоюються організмом людини майже повністю.
Ступінь чистої утилізації молочного білка в організмі людини становить 75%.
Амінокислотний скор жіночого молока становить майже 100%, скор коров’ячого молока - 95%. Білки коров’ячого молока багаті на лізин і треонін, лімітуючими амінокислотами є метіонін і цистеїн.
Завдяки колоїдному стану білки молока легкодоступні для дії травних ферментів. Харчова цінність білків збільшується завдяки тому, що вони утворюють комплекси з вітамінами, особливо групи В, і мінеральними речовинами.
Молоко містить більше ніж 20 білків. їх поділяють на дві групи: казеїни (складні білки) і сироваткові (прості білки). Вони відрізняються один від одного за молекулярною масою, ізоелектричною точкою, співвідношенням амінокислот, особливостями складу і структури.
Вміст казеїну в молоці становить 78-85% усіх білків. Казеїн має вигляд колоїдних частин або міцел (ниток), що складаються з більш дрібних частин (субміцел). Казеїн чутливий до дії іонів кальцію. За їх наявності випадає в осад. Казеїн є фосфопротеїном, оскільки містить у своєму складі фосфорну кислоту. Він приєднує до себе кальцій, магній, натрій, мінеральні речовини. У складі казеїну є чотири фракції, що відрізняються за вмістом амінокислот, фосфорної кислоти, за чутливістю до дії іонів кальцію та сичугового ферменту. Казеїн у молоці міститься у вигляді кальцій-фосфат-казеїновому комплексу. Він складається з казеїнату кальцію, колоїдного фосфату кальцію, лимонної кислоти,
Після осадження казеїну в ізозлектричній точці виявляються сироваткові білки. До їх складу входять (ß -лактаглобулін, ɑ -лактоальбумін, альбумін сироватки крові, імуноглобуліни і протеозопептидна фракція.
Лекція №5
Нуклеїнові кислоти
[ 1.с. 98-110; 2. с. 134-166 3. с. 320-343; 4. с. 60-77 ]
План
1. Загальна характеристика.
2. Хімічний склад і будова
3. Будова, властивості й біологічні функції РНК і ДНК
Нуклеїнові кислоти - біополімери, побудовані з мононуклеотидів. Вони поділяються на два класи - дезоксирибонуклеїнові кислоти (ДНК) та рибонуклеїнові (РНК).
Нуклеїнові кислоти є високомолекулярними сполуками з молекулярною масою від декількох тисяч(транспортні РНК) до кількох мільйонів даль тон(ДНК еукаріотів). Це- біополімери, які разом з білками належать до класу інформаційних біомакромолекул. Вони виконують ряд унікальних біологічних функцій, не властивих іншим біополімерам: забезпечують зберігання і передавання нащадкам спадкової інформації, беруть безпосередню участь умеханізмах реалізації цієї інформації шляхом програмування матричного синтезу всіх білків індивідуального організму.
Нуклеотиди є структурними компонентами (мономерними ланками) молекул нуклеїнових кислот ДНК та РНК. За хімічною будовою є трикомпонентними сполуками, що складаються з азотистої основи пуринового чи піримідинового ряду, залишків пентоз(рибози або дезоксирибози) та фосфату.
Будова, властивості і функції нуклеотидів
За умов повного гідролізу нуклеїнових кислот (кислотного або лужного) вивільняються пуринові та піримідинові азотисті основи, пентози (D-рибоза або 2- дезокси-D-рибоза) та фосфорна кислота.
В основі структури азотистих основ нуклеотидів лежать гетероциклічні сполуки пурин і піримідин.
Пуриновими основами, що входять до складу нуклеотидів нуклеїнових кислот, є: аденін(А) та гуанін(Г)

До складу нуклеотидів входять також три головні піримідинові основи:
цитозин(Ц), урацил(У), тимін(Т)

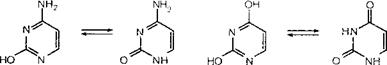 Цитозин Цитозин Урацил Урацил
(енольна форма) (кетоформа) (енольна форма) (кетоформа)
Цитозин Цитозин Урацил Урацил
(енольна форма) (кетоформа) (енольна форма) (кетоформа)
|
Нуклеозиди- двокомпонентні біоорганічні молекули, що складаються з азотистої основи пуринового чи піримідинового ряду та пентози (D-рибози або 2- дезокси-D-рибози) – рибонуклеозиди та дезоксирибонуклеозиди.
При D- фосфорилюванні АТФ (відщепленні одного залишку фосфорної кислоти) утворюється АДФ, потім АМФ –при відщепленні ще одного залишку. Цей процес супроводжується виділенням енергії, яка використовується в клітинах для процесів синтезу та інших видів роботи. В свою чергу АДФ за рахунок енергії, яка звільняється при окисненні органічних речовин, фосфорилюється в АТФ (енергія акумулюється).
В полінуклеотидах мононуклеотидні залишки з’єднуються між собою складно ефірними зв’язками.
Нуклеїнові кислоти поділяються на 2 групи, які відрізняються між собою складом і структурою – одні містять рибозу (РНК), інші -дезоксирибозу (ДНК).
Відмінності в будові пентодного залишку має певне біологічне значення. Заміна гідроксилу у другого атома Вуглецю рибози на Водень збільшує міцність цього кільця до хімічної взаємодії. Відсутність гідроксилу підвищує компактність молекул, можливість утворення другої спіралі.
ДНК і РНК відрізняються і азотистими основами: в ДНК не входить урацил, в РНК – тимін.
В ДНК входить аденін, гуанін, цитозин, тимін (АГЦТ)
У відповідності з п’ятьма азотистими основами існує п’ять нкулеотидів: аденін - аденілова кислота, гуанін - гуанілова, цитозин - цитидилова, урацил - уридилова, тимін - тимидилова.
ДНК відповідає за збереження і передачу спадкової інформації і властивостей організму(знаходиться в хромосомах ядер), РНК- за синтез білка (знаходиться в ядрі, цитоплазмі).
|
|