
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота № 15. Визначення невідомого газу за спектром його випромінювання
|
|
Мета роботи – вивчити спектральні закономірності атомів, проградуювати монохроматор УМ-2, визначити невідомий газ за спектром його випромінювання.
Вказівки до виконання лабораторної роботи
Для виконання лабораторної роботи необхідно вивчити такий теоретичний матеріал: закономірності спектрів атомів; спектри випромінювання атомів водню; формула Бальмера; енергетичні рівні атома водню; квантові числа, їх фізичний зміст; принцип Паулі; електронні оболонки складних атомів; поняття про енергетичні рівні молекул; спектри молекул.
[1, т.3, §§ 13.1 – 13.9; 2, §§ 209, 212, 227, 230, 231; 3, розд. 12, §§ 3 – 9; 4, т.3, §§ 12, 17, 28 – 30, 36, 39, 40]
Спектри випромінювання – це розподіл за частотами (довжинами хвиль) інтенсивності світла, яке випромінюється атомами, молекулами або розжареними твердими тілами. Спектри поглинання – це розподіл за довжинами хвиль інтенсивності поглинання світла при проходженні його через різні речовини. Спектри поглинання і випромінювання бувають трьох типів: суцільні, смугасті та лінійчаті.
Механізм утворення спектрів поглинання і випромінювання пояснюється атомною теорією будови речовини. Випромінювання світла відбувається при переході електрона з енергетичного рівня з більшою енергією на рівень з меншою енергією (рис. 15.1.).
Енергія випроміненого кванта (перехід 1®2) відповідно постулатів Бора:
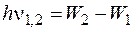 .
.
Поглинання світла відбувається при переході електрона з меншою W 1 на більший рівень енергії W 2.
Якщо енергетична схема рівнів системи складається з поодиноких, відносно далеко розміщених один від одного рівнів, то при переході електронів між цими рівнями утворюються лінійчаті спектри. Таку схему рівнів мають атоми речовин (рис. 15.1, а).
 |
Якщо енергетична схема рівнів системи складається з групи близько розташованих рівнів, а групи розділені значними проміжками, то переходи між цими рівнями утворюють спектри, які складаються з групи ліній, що зливаються у смуги (смугасті спектри). Таку схему рівнів мають молекули. На приведеному малюнку показано виникнення коливально-обертального спектру молекул (рис. 15.1, в).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Якщо енергетична схема рівнів системи складається з множини дуже близько розташованих один від одного рівнів (відстань між рівнями дорівнює 10-28еВ), то при переході між цими рівнями утворюється суцільний спектр. Суцільний спектр випромінюють нагріті тверді тіла (рис. 15.1, б).
В даній лабораторній роботі вивчаються лінійчаті спектри випромінювання.
Довжини хвиль  лінійчатого спектра випромінювання можна розрахувати для простого атома водню з допомогою формули Бальмера:
лінійчатого спектра випромінювання можна розрахувати для простого атома водню з допомогою формули Бальмера:
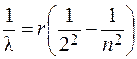 ,
,
де R – стала Рідберга, n = 3, 4, 5, …
Спектри більш складних атомів розраховувати з допомогою цих формул неможливо. Для визначення довжини хвиль таких ліній використовують спектральні прилади – спектрометри. В даній лабораторній роботі використовується універсальний монохроматор УМ-2.
Він складається з таких блоків (рис. 15.2): 1 – коліматор (труба К, щілина S та об’єктив О1); 2 – призма П; 3 – зорова труба О та окуляр О2; 4 – відліковий пристрій М.
На рисунку 15.2 LL / та NN / – оптичні вісі коліматора та зорової труби відповідно.
Призначення коліматора К – дати паралельний пучок світла, який падає на призму П монохроматора, для чого щілина S розташована у фокальній площині об’єктива паралельно ребру призми. Призма у монохроматорі має складну будову.
 |
У зв’язку з тим, що паралельні пучки променів, які вийшли з призми, за рахунок дисперсії світла мають різний колір (різну довжину хвиль), то вони мають і різний напрям. Ці промені у фокальній площині об’єктива F зорової труби утворюють ряд паралельно пофарбованих зображень щілини, які розглядають через окуляр О2 зоровоїтруби О.
Для визначення відносного положення смуг або ліній в спектрі править покажчик у вигляді темної нерухомої лінії, паралельній зображенням ліній. Положення лінії і покажчика фіксується з допомогою мікрометричного гвинта М. На циліндрі цього гвинта М розташовані цифри, за якими і визначається положення ліній спектрів.
Для отримання лінійчатих спектрів використовують заповнені газом спектральні трубки, які світяться під дією високої напруги. При проходженні струму атоми газу збуджуються, тобто електрони переходять на більш високі енергетичні рівні. Перехід електронів із збудженого стану у не збуджений призводить до появи спектру випромінювання. Так як атоми кожного елемента мають характерну тільки для них схему рівнів, спектри випромінювання різних атомів відрізняються один від одного. Це явище і використовують для розпізнавання роду атомів за спектрами випромінювання (спектральний аналіз).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Для визначення довжин хвиль невідомого газу спочатку за відомими довжинами хвиль (наприклад, атома водню) треба проградуювати шкалу монохроматора, тобто побудувати графік залежності між довжиною хвилі (l) та поділками мікрометричного гвинта (N), а потім, використовуючи цей графік, визначити довжини хвиль невідомих ліній і, порівнявши їх з табличними даними, визначити невідомий газ.
Хід роботи
Перед початком роботи слід ознайомитись з правилами техніки безпеки.
1. Проградуювати монохроматор УМ-2. Для цього перед щілиною коліматора розмістити трубу з еталонним газом (Н2 або Nе2), довжини хвиль яких відомі. Покажчик навести послідовно на лінії спектру, визначити при цьому показники мікрометричного гвинта і дані занести в таблицю 15.1.
2. Побудувати на міліметровому папері графік l = f (N). Спектр розглядати від крайньої червоної лінії.
3. Визначити довжини хвиль невідомого газу. Для цього перед щілиною коліматора вставити трубку з невідомим газом. Покажчик послідовно наводити на невідомі лінії, відраховуючи при цьому показники мікрометричного гвинта. Дані занести в таблицю 15.1.
4. За графіком l = f (N) визначити довжини хвиль невідомого газу. За табличними даними визначити газ, якому належить такий спектр.
Таблиця 15.1
| Назва елемента | Колір лінії | Довжина хвилі, нм | Відлік по шкалі мікрометричного гвинта, (N) |
| Водень | 1. Яскраво-червона 2. Зелена 3. Фіолетова | 656, 2 486, 1 410, 1 | |
| Неон | 1. Яскраво-червона 2. Червоно-оранжева 3. Оранжева 4. Зелена 5. Синьо-зелена 6. Фіолетова | 640, 2 614, 3 594, 5 540, 0 533, 0 484, 9 | |
| Невідомий газ | 1. 2. 3. |
Контрольні питання
1. Які види та природа спектрів?
2. Який механізм виникнення спектрів випромінювання та поглинання.
3. Поясніть механізм виникнення лінійчатих спектрів.
4. Формула Бальмера та її пояснення.
5. Молекулярні спектри та їх пояснення.
6. В чому полягає явище дисперсії? Які є види дисперсії?
7. Яка будова та принцип дії монохроматора УМ-2?
8. Як проградуювати монохроматор? Як визначити довжину невідомої лінії спектра?
|
|
