
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Области перехода окраски некоторых рН-индикаторов
|
|
| Индикатор | Окраска кислотной формы | Окраска щелочной формы | Область перехода рН | рТ |
| Фенолфталеин | Бесцветная | Красная | 8, 0-10, 0 | 9, 0 |
| Лакмус | Красная | Синяя | 5, 0-8, 0 | 7, 0 |
| Метил-оранж | Розовая | Желтая | 3, 1-4, 4 | 4, 0 |
| Метил-красный | Красная | Желтая | 4, 2-6, 2 | 5, 5 |
Такие цветные индикаторы должны проявлять свойства, положенные в основу соответствующей титриметрической реакции. Индикация растворов может проводиться как визуально, так и с использованием инструментальных методов. Если проба или титрант сами по себе окрашены, специальные индикаторы могут и не потребоваться.
Расчет концентрации исследуемого раствора, в соответствии с законом эквивалентов, проводят по формуле:
С экв 1 V 1 = С экв 2 V 2, (7)
где С экв 1 и С экв 2 – молярные концентрации эквивалента пробы и титранта, соответственно, моль экв/л; V 1 – отмеренный объем пробы, л; V 2 – объем титранта, израсходованный на титрование, л.
При определении концентраций кислот и оснований используют метод кислотно-основного титрования, в основе которого лежит реакция нейтрализации:
Н+ + ОН- D Н2О.
В кислотной среде концентрация ионов водорода Н+ больше концентрации гидроксид-ионов ОН-, а в щелочной среде, наоборот, меньше. Для удобства характеристики среды используют понятие водородного показателя рН, численно равного отрицательному десятичному логарифму молярной концентрации ионов водорода в растворе:
рН = -lg 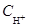 . (8)
. (8)
Поскольку в водных растворах произведение молярных концентраций ионов водорода и гидроксид-ионов:
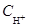 ×
× 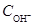 =
= 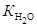 , (9)
, (9)
называемое ионным произведением воды, – величина постоянная и при Т =298К 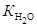 = 10-14, в нейтральной среде рН = 7, в кислотной рН < 7, в щелочной рН > 7.
= 10-14, в нейтральной среде рН = 7, в кислотной рН < 7, в щелочной рН > 7.
Истинная точка эквивалентности кислотно-основного титрования соответствует равенству молярных концентраций ионов водорода Н+ и гидроксид-ионов ОН-:
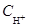 =
= 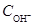 .
.
Реакция нейтрализации не сопровождается видимыми изменениями, например, переменой окраски раствора. Поэтому для фиксирования точки эквивалентности используют органические красители, структура и окраска которых зависит от величины водородного показателя рН.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Как видно из табл.2, изменение окраски важнейших кислотно-основных индикаторов происходит внутри определенного узкого интервала значений рН растворов. Этот интервал зависит только от свойств данного индикатора, поэтому перемена окраски индикатора происходит, как правило, не строго в точке эквивалентности, а с известным отклонением от нее. То значение рН, при котором заканчивается титрование с данным индикатором, называется показателем титрования и обозначается рТ. Величина рТ соответствует одной из промежуточных окрасок индикатора и находится внутри области перехода.
Следует учитывать, что экспериментально наблюдаемая конечная точка титрования вследствие погрешностей измерений и наблюдений отличается от истинной точки эквивалентности, соответствующей стехиометрическим соотношениям реагирующих веществ. Очевидно, что от выбора индикатора зависит индикаторная ошибка титрования, величина которой может колебаться в широких пределах в зависимости от того, какой взят индикатор и какие кислота и основание реагируют между собой. Так, в случае титрования кислоты основанием, при рТ< 7 (при 298К) имеет место недотитрованность, а при рТ> 7 – перетитрованность. Относительная систематическая погрешность титрования:
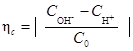 100% (10),
100% (10),
где 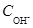 ,
, 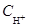 и С 0 – молярные концентрации ионов ОН-, Н+ и титруемого вещества соответственно.
и С 0 – молярные концентрации ионов ОН-, Н+ и титруемого вещества соответственно.
Например, при титровании 0, 01 М раствора сильной кислоты раствором сильного основания в присутствии фенолфталеина (рТ=9) 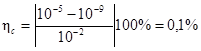 .
.
Вопросы для предварительной подготовки лабораторной работы
1. Что такое раствор? растворитель? растворенное вещество?
2. Какие способы выражения состава раствора вы знаете?
3. Что такое титриметрия? В чем заключается принцип титрования? Напишите выражение основной расчетной формулы определения концентрации методом титрования.
4. Что " показывает" водородный показатель рН?
5. На каком свойстве индикаторов основано их применение?
6. Что такое показатель титрования рТ? Каково его значение для индикаторов метилового оранжевого и фенолфталеина?
|
|
