
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет № 24. 1. Аммиак: состав молекулы, химическая связь в молекуле
|
|
1. Аммиак: состав молекулы, химическая связь в молекуле. Физические и химические свойства аммиака.
Молекулярная формула аммиака NH3. Три атома водорода соединены с азотом ковалентными полярными связями (азот более электроотрицателен). В образовании связей принимают участие три неспаренных электрона азота и по одному электрону водорода. Структурная формула:
H – N – H
l
H
Молекула аммиака имеет форму треугольной пирамиды, в вершинах которой находятся атомы азота и водорода. Угол между связями N–H около 107о
Аммиак – бесцветный газ с характерным резким запахом. Легче воздуха, его можно собирать в перевернутые вверх дном сосуды. Аммиак хорошо растворяется в воде (в 1 литре воды при комнатной температуре растворяется около 700 литров аммиака). При повышенном давлении аммиак легко переходит в жидкое состояние. При последующем испарении поглощается много тепла, поэтому его используют в качестве хладагента в холодильных установках.
Аммиак химически активен. Наличие у атома азота неподелённой электронной пары, не участвующей в образовании связей, делает возможным присоединение протона и образования еще одной, донорно-акцепторной связи, обозначаемой стрелкой:
H
l
[H – N → H ]+
l
H
Ион аммония образуется, например, при растворении аммиака в воде:
NH3 + H2O 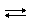 NH4+ + OH –
NH4+ + OH –
Поэтому раствор аммиака обладает щелочными свойствами и окрашивает индикатор фенолфталеин в малиновый цвет.
Аммиак взаимодействует с кислотами. Если близко поднести стеклянные палочки, смоченные концентрированным раствором аммиака и концентрированной соляной кислотой, образуется «дым» из кристалликов хлорида аммония:
NH3 + HCl = NH4Cl
Аммиак горит в кислороде с образованием молекулярного азота:
4NH3 + 3O2 = 2N2 + 6H2O
В присутствии платины в качестве катализатора, азот аммиака окисляется до оксида азота (II):
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
4NH3 + 5O2 = 4NO + 6H2O
Эта реакция используется в производстве азотной кислоты и азотных удобрений. 10%-ный раствор аммиака в воде используется в медицине под названием «нашатырный спирт».
При нагревании аммиак разлагается (реакция обратная синтезу):
2NH3 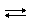 N2 + 3H2
N2 + 3H2
|
|
