
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет № 16. 1. Сера: положение этого химического элемента в периодической системе, строение его атома
|
|
1. Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства.
Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе.
Атомный номер серы 16, следовательно, заряд атома серы равен + 16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
16S)))
2 8 6
Ядро атома серы 32S содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: 32 – 16 = 16).
Сера как простое вещество образует две аллотропные модификации: кристаллическая сера и пластическая.
Кристаллическая сера – твердое вещество желтого цвета, хрупкое, легкоплавкое (температура плавления 112° С), нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой. Поэтому порошок серы может плавать на поверхности, хотя сера тяжелее воды (плотность 2 г/см3).
На этом основан метод обогащения руд под названием флотация: измельченная руда погружается в емкость с водой, через которую продувается воздух. Частички полезной руды подхватываются пузырьками воздуха и выносятся наверх, а пустая порода (например, песок) оседает на дно.
Пластическая сера темного цвета и способна растягиваться, как резина.
Это отличие в свойствах связано со строением молекул: кристаллическая сера состоит из кольцевых молекул, содержащих 8 атомов серы, а в пластической сере атомы соединены в длинные цепи. Пластическую серу можно получить, если нагреть серу до кипения и вылить в холодную воду.
В уравнениях для простоты записывают серу без указания числа атомов в молекуле: S.
Химические свойства:
- В реакциях с восстановителями: металлами, водородом, – сера проявляет себя как окислитель (степень окисления -2, валентность II). При нагревании порошков серы и железа образуется сульфид железа:
Fe + S = FeS
Со ртутью, натрием порошок серы реагирует при комнатной температуре:
Hg + S = HgS - При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S - В реакциях с сильными окислителями сера окисляется. Так, сера горит, образуется оксид серы (IV) – сернú стый газ:
S + O2 = SO2
Оксид серы (IV) – кислотный оксид. Реагирует с водой с образованием сернú стой кислоты:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
SO2 + H2O = H2SO3
Эта реакция происходит в атмосфере при сжигании каменного угля, который обычно содержит примеси серы. В результате выпадают кислотные дожди, поэтому очень важно подвергать очистке дымовые газы котельных.
В присутствии катализаторов оксид серы (IV) окисляется до оксида серы (VI):
2SO2 + O2 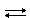 2SO3 (реакция обратима)
2SO3 (реакция обратима)
Оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O = H2SO4
SO3 – бесцветная жидкость, кристаллизуется при 17° С, переходит в газообразное состояние при 45° С
|
|
