
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. При электролизе растворов солей:
|
|
При электролизе растворов солей:
На катоде (-) в первую очередь восстанавливаются те ионы (атомы молекулы), потенциалы которых наиболее высокие (см. таблицу26).
Активные металлы от Li до Al не разряжаются на катоде, т.к. имеют более отрицательное значение электродных потенциалов, чем водород. В этом случае будет восстанавливаться H+ из воды. Если электродный потенциал металла более положителен, чем водородный потенциал (металлы стоящие в ряду напряжений после водорода) на катоде разряжаются ионы металла. Если электродный потенциал металла не ниже (-1), то могут восстанавливаться на катоде металлы (от Zn до H).
На аноде (+) будут разряжаться (окисляться) ионы (атомы, молекулы), потенциалы которых в данных условиях наиболее низкие (табл.26).
1) На нерастворимых анодах окисляются анионы бескислородных кислот: S-2, I-, Br–, Cl-.
2) Кислородсодержащие анионы (SO42-, NO3-, SO32- и F-) не разряжаются. В этом случае окисляются анионы OH- из воды.
3)На металлических (растворимых) анодах разрушается материал самого анода, т.к. электродный потенциал металла более отрицательный по сравнению с потенциалом H- и других анионов.
Схемы процесса электролиза солей:
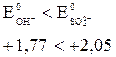 а)
а) 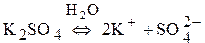
 –K
–K
H2
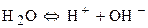
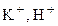
Процесс восстановления:
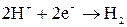
Побочный процесс:
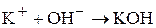
+А
O2
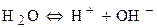
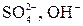
Процесс окисления:
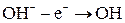
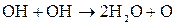
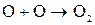
Побочный процесс:
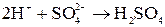
Суммарное уравнение процесса электролиза:
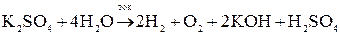
Т.е. при электролизе раствора соли, образованной активным металлом и кислородсодержащим анионом, происходит электрохимическое разложение воды.
б) 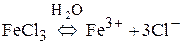
–K
|
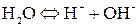
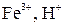
Процесс восстановления:

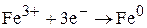
+А
|
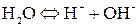

Процесс окисления:
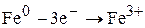
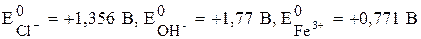 |
При электролизе растворов с металлическим анодом окисляется материал анода, т.к. имеет меньшее значение электродного потенциала.
|
|
