
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример. Приведите схему работы гальванического элемента (Г.Э.)
|
|
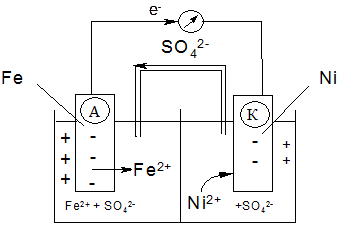 Приведите схему работы гальванического элемента (Г.Э.). Напишите уравнения электродных процессов с указанием анода и катода. Приведите уравнение токообразующей реакции. Рассчитайте ЭДС элемента, составленного из железной и никелевой пластин, погруженных в растворы своих солей с концентрацией 0, 1 моль/л.
Приведите схему работы гальванического элемента (Г.Э.). Напишите уравнения электродных процессов с указанием анода и катода. Приведите уравнение токообразующей реакции. Рассчитайте ЭДС элемента, составленного из железной и никелевой пластин, погруженных в растворы своих солей с концентрацией 0, 1 моль/л.
Решение:
В приведенном процессе участвуют две окислительно-восстановительные пары Fe0/Fe2+ и Ni0/Ni2+. Потенциалы этих пар можно рассчитать по уравнению Нернста:
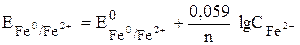 , где
, где
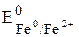 – стандартный потенциал железа, равный -0, 440 В,
– стандартный потенциал железа, равный -0, 440 В,
n – заряд иона металла
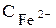 - концентрация иона металла, равная 0, 1 моль/л по условию задачи.
- концентрация иона металла, равная 0, 1 моль/л по условию задачи.
Подставив данные условия задачи, рассчитаем потенциал железного электрода:
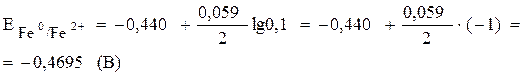
Рассчитаем потенциал никелевого электрода:
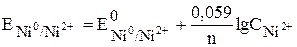
Стандартный потенциал никеля:
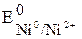 = - 0, 250 В, тогда
= - 0, 250 В, тогда
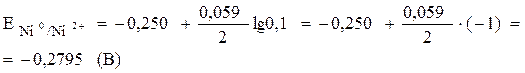
Поскольку потенциал железного электрода имеет меньшее значение, чем никелевого, то в гальваническом элементе железо является анодом, а никель – катодом.
Г.Э. можно изобразить схемой, соответствующей окислительно-восстановительному Г.Э.
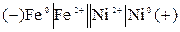 При работе элемента протекают реакции:
При работе элемента протекают реакции:
на аноде 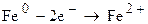
на катоде 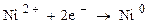
При замыкании внешней цепи электроны перейдут от анода к катоду. Переход сульфат-ионов осуществляется через проводник II рода
(U-образную трубку, заполненную токопроводящим материалом).
Просуммировав процессы, протекающие на электродах в замкнутом гальваническом элементе, получаем токообразующую реакцию:
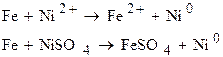
Для определения ЭДС Г.Э. необходимо из потенциала катода вычесть потенциал анода:
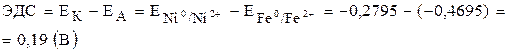
|
|
