
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Другий і третій закони термодинаміки
|
|
Перший закон термодинаміки, який встановив кількісний зв’язок між теплотою, роботою і внутрішньою енергією системи, не дозволяє визначити напрямок протікання термодинамічних процесів.
Другий закон термодинаміки якраз вказує на напрямок теплових процесів, що відбуваються в природі.
Згідно із Клаузіусом, який дав одне з перших формулювань другого закону,
теплота ніколи не може переходити сама собою від тіл з нижчою температурою до тіл з вищою температурою.
Це означає, що для такого переходу теплоти потрібна затрата роботи зовнішнього джерела, що здійснюється в холодильній машині.
Фізичний зміст другого закону найбільш зрозуміло розкривається у формулюванні Планка:
неможливо побудувати таку періодично діючу теплову машину, яка, отримавши ззовні деяку кількість теплоти при довільній температурі, цілком перетворювала би її в механічну роботу і при цьому поверталась би точно у вихідний стан.
коефіцієнт корисної дії ідеальної теплової машини визначається лише температурами нагрівника i холодильника.
Кельвін сформулював другий закон термодинаміки в такому вигляді:
неможливо побудувати теплову машину, яка виконувала би роботу за рахунок теплоти найбільш холодного з тіл, що є в системі.
Оскільки реальні процеси не оборотні, то всі процеси в замкненій системі ведуть до збільшення її ентропії. Цей принцип лежить в основі формулювання другого закону термодинаміки:
можливі лише такі процеси, що відбуваються в макроскопічній замкненій системі, які ведуть до збільшення її ентропії.
Формула Больцмана дозволяє дати таке статистичне тлумачення другому закону термодинаміки:
термодинамічна ймовірність стану ізольованої системи при всіх процесах, що в ній відбуваються не може зменшуватися.
при абсолютному нулі температури будь-які зміни стану відбуваються без зміни ентропії:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
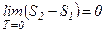 .
.
теорему Нернста – третій закон термодинаміки можна сформулювати так:
при абсолютному нулі ентропія дорівнює нулю:
 .
.
Третій закон термодинаміки заперечує можливість досягнення абсолютного нуля. Справді, всі процеси, які протікають з теплопередачею, супроводжуються зміною ентропії. Це означає, що при 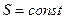 процес з теплопередачею не
процес з теплопередачею не
можливий, тобто при 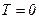 система більше не віддає теплоти, тобто не охолоджується.
система більше не віддає теплоти, тобто не охолоджується.
Отже, не можна створити машину, яка здатна взяти всю теплоту від тіла, тобто охолодити його до абсолютного нуля.
Рівняння Ван-дер-Ваальса для довільної маси m газу 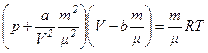

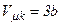 ,
, 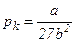 ,
, 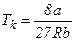 .
.
Отже, критичні величини 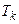 ,
, 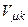 ,
, 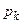 безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
безпосередньо виражаються через Ван-дер-Ваальсівські поправки a і b.
Якщо через крайні точки горизонтальних ділянок сімейства Ван-дер-Ваальсівських ізотерм провести лінії, то одержуємо криву, що обмежує область двофазних станів речовини
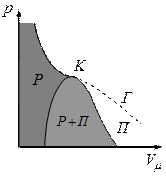
Якщо газ розширюється без теплообміну з навколишнім середовищем 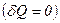 і не виконує зовнішньої роботи
і не виконує зовнішньої роботи 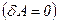 , то на основі першого закону термодинаміки
, то на основі першого закону термодинаміки 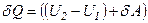 , отримуємо, що
, отримуємо, що  .
.
При адіабатному розширенні без виконання зовнішньої роботи внутрішня енергія газу не міняється.
Для ідеального газу  означає рівність температур
означає рівність температур 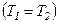 , тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.
, тобто при адіабатному розширенні ідеального газу у вакуумі його температура не змінюється.
Для реального газу:
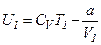 і
і 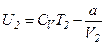 .
.
З умови  отримуємо
отримуємо
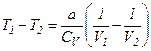 .
.
Оскільки 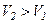 , то
, то 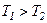 , тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.
, тобто реальний газ при адіабатному розширенні у вакуум охолоджується. При адіабатному стиску реальний газ нагріватиметься.
|
|
