
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методы защиты металлов от коррозии
|
|
Все методы защиты условно делятся на следующие группы:
а)легирование металлов;
б) защитные покрытия;
в) электрохимическая защита;
г) изменение свойств коррозионной среды;
д) рациональное конструирование изделия.
При легировании в состав сплава вводят компоненты, вызывающие пассивность металла. Легирующими добавками в сталь являются Cr, Ni, W и другие.
Защитные покрытия исключают контакт металла с атмосферой и электролитом. Покрытия могут быть органическими (лаки, краски, эмали, полимерные пленки), металлическими. Последние подразделяются на катодные и анодные. К катодным относятся покрытия, потенциал которых имеет более положительное значение, чем потенциал основного металла. Например, для стали катодными покрытиями могут служить медь, никель, серебро.
При повреждении покрытия возникает гальванический элемент, в котором защищаемый металл служит анодом и окисляется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород.
Рассмотрим процессы, протекающие на электродах при нарушении катодного покрытия в случае «луженого» железа.
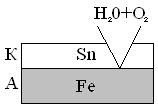
A Fe|H2O + O2| Sn K
e0 Fe/Fe2+ = -0.44B e0 Sn/Sn2+ = -0, 14B
 2 A: Fe –2e = Fe2+
2 A: Fe –2e = Fe2+
1 K: 2H2O + O2 + 4e = 4OH-
 2Fe + 2H2O = O2 = 2Fe(OH)2
2Fe + 2H2O = O2 = 2Fe(OH)2
Электроны переходят от железа к олову, где связываются молекулами кислорода в присутствии молекул воды.
В случае анодных покрытий материал покрытия имеет более отрицательный потенциал, чем потенциал основного металла. Примером анодного покрытия для железа могут быть такие металлы, как цинк, алюминий, хром, титан. При нарушении анодного покрытия в случае «оцинкованного» железа защищаемый металл не разрушается, разрушается само покрытие.
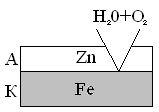
 A Zn | H2O + O2 | Fe K
A Zn | H2O + O2 | Fe K
2 A Zn – 2e = Zn2+
 1 K 2H2O + O2 + 4e = 4OH-
1 K 2H2O + O2 + 4e = 4OH-
2Zn + 2H2O + O2 = 2Zn(OH)2
Методы электрохимической защиты основаны на создании гальванического элемента, в котором роль катода выполняет защищаемый металл (деталь, конструкция). Если к защищаемой конструкции присоединить кусок более активного металла (например, магния), то в среде электролита конструкция будет выполнять роль катода, а магний (протектор) – функцию анода (протекторная защита).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Катодная защита исключает возможность разрушения конструкции за счет подключения ее к катоду (отрицательному полюсу) внешнего источника тока, а анодом служит металлоломом.
Для снижения агрессивности среды уменьшают концентрацию кислорода, ионов водорода.
|
|
