
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Процессы на катоде
|
|
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов. Чем больше величина электродного потенциала элемента, тем легче его восстановление.
Первыми на катоде восстанавливаются ионы тех металлов, потенциал которых самый положительный. Например, раствор с ионами Ag+ и H+. Первым восстанавливается Ag:
Ag+ + e- = Ag0 e0 = +0, 8 B
Водород не восстанавливается, так как его потенциал меньше.
Потенциалы металлов и водорода зависят от их концентрации в электролите. Поэтому по значениям стандартного потенциала судить о восстановлении ионов Н+ не всегда можно. В нейтральном расторе концентрация ионов водорода равна10-7 моль/л. и по формуле Нернста: 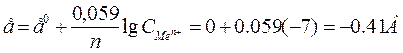
Следовательно водород может выделяться из нейтральных растворов только при потенциале меньше –0, 41В, а металлы на катоде будут выделяться лишь те, потенциал которых положительнее потенциала –0, 41В.
На практике из водородных растворов выделяется немало металлов (Zn, Fe, Cr и др.), значение электродных потенциалов которых менее –0, 41В.
Это объясняется перенапряжением водорода, т.е. на поверхности большинства металлов водород выделяется с затруднениями. Величина перенапряжения водорода зависит от свойств металла, плотности тока и температуры электролита. Перенапряжение – зто разница потенциалов между практическим потенциалом выделением водорода и теоретическим.
Пример.
Потенциал выделения цинка в нейтральном электролите –0.76В, водорода –0.41В. перенапряжение водорода на цинке около –0.72В. Таким образом, водород на цинке будет выделяться лишь при потенциале –0.41+(-0.72)=-1.13В. Если сравнить потенциал разряда цинка (-0.76 В) с потенциалом разряда водорода на цинке (-1.13В), ясно, что будет выделяться цинк. На деле так и есть, при электролизе нейтрального раствора соли цинка выделяется цинк и малое количество водорода.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
При обобщенном процессе на катоде, в зависимости от нахождения металла в ряду стандартных электродных потенциалов, выделяются три случая:
1) ионы металлов, электродный потенциал которых менее –1.18В (от Li до Mn). Восстанавливаются ионы водорода:
2 Н+ + 2е- = Н2 РН < 7
2 Н2О + 2е- = Н2 + 2ОН- РН > = 7
2) ионы металлов, электродный потенциал которых от –1.18В до 0.00В (от Mn до Н) В этом случае восстанавливаются как ионы металлов, так и ионы водорода одновременно:
Men+ + ne- = Me0
2H+ + 2e- = H2 PH< 7
2H2O + 2e- = H2 + 2OH- PH> =7
3) ионы металлов, электродный потенциал которых больше 0.0В (от H до Au). В этом случае восстанавливаются только ионы металлов
Меn+ + ne- = Me0
|
|
