
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретическое введение. Металлы, имея низкие потенциалы ионизации, легко отдают валентные электроны и образуют положительно заряженные ионы:
|
|
Металлы, имея низкие потенциалы ионизации, легко отдают валентные электроны и образуют положительно заряженные ионы:
M − nē = Mn+.
Поэтому металлы в химических реакциях являются восстановителями и способны взаимодействовать с различными веществами − окислителями.
Рассмотрим некоторые типичные случаи такого взаимодействия.
1. Металлы высокой химической активности могут разлагать воду с вытеснением водорода при комнатных температурах:
2K + 2H2O = 2KOH + H2.
2. С кислотами металлы реагируют различно в зависимости от активности самого металла и окислительных свойств кислоты:
– В разбавленной серной кислоте и в растворах галогеноводородов окислителем является ион H +, поэтому в них растворяются металлы, стоящие в ряду напряжений до водорода:
Cd + H2SO4 (разб.) = CdSO4 + H2;
Ni + 2HCl = NiCl2 + H2.
– Концентрированная серная кислота является окислителем за счет S+6 и может при нагревании окислять металлы, стоящие в ряду напряжений после водорода. Продукты ее восстановления могут быть различными в зависимости от активности металла. При взаимодействии с малоактивными металлами кислота восстанавливается до SO2:
Hg + 2H2SO4 (конц.) = HgSO4 + SO2 + 2H2O.
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород:
Cd + 2H2SO4 (конц.) = CdSO4 + SO2 + 2H2O;
3Zn+ 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O;
4Mg + 5H2SO4 (конц.) = 4MgSO4 + H2S + 4H2O.
В этих реакциях часть молекул серной кислоты играют роль среды.
– Азотная кислота является сильнейшим окислителем за счет N+5. Продукты восстановления различны и зависят от концентрации кислоты и активности металла:
HNO3 → NO2 → NO → N2O → N2 → NH4NO3.
При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взаимодействии разбавленной азотной кислоты с малоактивными металлами выделяется NO. В случае более активных металлов выделяется N2O. Сильно разбавленная азотная кислота взаимодействует с активными металлами с образованием иона аммония, дающего с кислотой нитрат аммония.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Ag + 2HNO3 (конц.) = AgNO3 + NO2 + H2O;
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO + H2O;
4Mg + 10HNO3 (разб.) = 4Mg(NO3)2 + N2O + 5H2O;
4Ca + 10HNO3 (оч. разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O.
Al, Fe, Cr концетрированной азотной кислотой пассивируются.
3. Со щелочами реагируют металлы, дающие амфотерные гидроксиды (бериллий, цинк, алюминий, олово, свинец), а также металлы, обладающие высокими степенями окисления в присутствии сильных окислителей:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2;
2Mo + 4KOH + 3O2 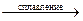 2K2MoO4 + 2H2O.
2K2MoO4 + 2H2O.
|
|
