
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Газового фонтана
|
|
1. Дебит газового фонтана (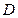 , млн. м3/сутки) может быть рассчитан из высоты факела пламени по формуле (4):
, млн. м3/сутки) может быть рассчитан из высоты факела пламени по формуле (4):
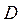 = 0, 0025∙
= 0, 0025∙ 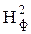 млн.м3/сутки
млн.м3/сутки
2. Режим истечения газовой струи может быть определён из сравнения эффективной скорости истечения (uэ)со скоростью звука (u0):
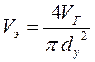 , (5)
, (5)
где V г− секундный расход газа, м3/с, 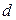 у − диаметр устья скважины, м.
у − диаметр устья скважины, м.
Скорость звука в метане (u0)составляет 430 м/с.
3. Для расчёта адиабатической (Та) и действительной (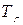 ) температуры процесса горения необходимо определить теплоту сгорания, т.е. количество тепла, выделяемое при полном сгорании 1 м3 фонтанирующего газа с учётом его химического состава.
) температуры процесса горения необходимо определить теплоту сгорания, т.е. количество тепла, выделяемое при полном сгорании 1 м3 фонтанирующего газа с учётом его химического состава.
Теоретическая (адиабатическая) температура процесса горения рассчитывается с учётом полного адиабатического сгорания газообразного вещества (теплопотерями в окружающую среду пренебрегают).
Остановимся на методике расчета Та, основываясь на анализе энергетического баланса химической реакции.
Для его упрощения можно воспользоваться значением стандартной энтальпии сгорания при 298.15 K (- 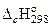 ), а вместо истинных теплоемкостей веществ - их средними значениями, взятыми в температурном интервале 289-2000 К.
), а вместо истинных теплоемкостей веществ - их средними значениями, взятыми в температурном интервале 289-2000 К.
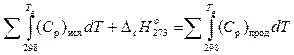 , (6)
, (6)
где 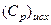 − теплоёмкость исходных веществ;
− теплоёмкость исходных веществ;
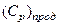 − теплоёмкость продуктов горения (в том числе свободного кислорода);
− теплоёмкость продуктов горения (в том числе свободного кислорода);
Та − адиабатическая температура процесса горения.
Количество тепла, выделяющееся при полном сгорании одного моля, единицы массы или объёма вещества, называется теплотой сгорания (Qс, 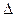 сН). Стандартная энтальпия сгорания кислорода, жидкой воды, газообразного диоксида углерода (СО2) и других высших оксидов в стандартных состояниях равна нулю при любой температуре (
сН). Стандартная энтальпия сгорания кислорода, жидкой воды, газообразного диоксида углерода (СО2) и других высших оксидов в стандартных состояниях равна нулю при любой температуре (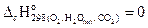 ), так они не способны окисляться.
), так они не способны окисляться.
Значения теплот сгорания органических соединений можно найти в справочной литературе или рассчитать, используя первое следствие из закона Гесса, которое гласит: тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Высшей теплотой сгорания Qсв (∆ сНв) называют количество теплоты, выделяемое при полном сгорании единицы массы или объёма горючего вещества при условии, что вода выделяется в конденсированном состоянии.
Низшей теплотой сгорания Qсн (∆ сНн) называют количество теплоты, выделяемое при полном сгорании единицы массы или объёма горючего вещества при условии, что вода выделяется в виде пара и происходит испарение влаги, содержащейся в горючем веществе.
В пожарно-технических расчётах обычно используют низшую теплоту сгорания, так как в условиях пожарах вода как продукт реакции находится в парообразном состоянии.
Используя справочную литературу для нахождения теплот (энтальпий) образования веществ и проводя теплотехнические расчёты, необходимо помнить, что тепловой эффект реакции ∆ rН0т и теплота сгорания Qс. имеют одинаковые численные значения, но разный знак, т.е. Qс = − 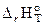 .
.
При расчетах температуры горения пользуются величиной Q н, так как при температуре горения вода находится в газообразном состоянии. Значения низшей теплоты сгорания вещества (тепловой эффект химической реакции) приводится в справочной литературе. Эта величина может быть рассчитана по закону Гесса, который говорит о том, что тепловой эффект химической реакции равен разности сумм теплоты образования продуктов реакции и теплоты образования исходных веществ.
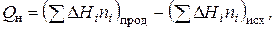 (7)
(7)
В уравнении (7) D Hi - теплота образования i -того вещества, ni - количество молей i -того вещества.
После интегрирования уравнения (6) получим выражение для расчёта адиабатической температуры горения:
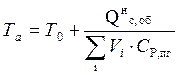 (8)
(8)
Действительная температура горения всегда ниже адиабатической, так как часть тепла теряется с излучением. При расчёте действительной температуры горения учитываются потери тепла в результате химического недожога в зоне горения, когда образуются продукты неполного сгорания (СО, С, 
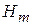 и др.) и потери тепла за счёт излучения факела пламени.
и др.) и потери тепла за счёт излучения факела пламени.
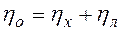 , (9)
, (9)
где 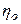 - общие теплопотери при горении газового фонтана, представляющие собой долю от низшей теплоты сгорания
- общие теплопотери при горении газового фонтана, представляющие собой долю от низшей теплоты сгорания 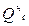 ;
;
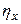 - химический недожог (0, 10);
- химический недожог (0, 10);
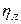 -коэффициент теплопотерь излучением.
-коэффициент теплопотерь излучением.
Коэффициент теплопотерь излучением от пламени газового фонтана может быть определен в соответствии со следующей формулой:
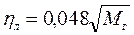 . (10)
. (10)
Молекулярную массуфонтанирующего газа (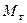 ), состоящего из нескольких компонентов, можно определить по формуле:
), состоящего из нескольких компонентов, можно определить по формуле:
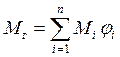 , (11)
, (11)
где 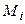 − молекулярная масса i -гo горючего компонента газового фонтана;
− молекулярная масса i -гo горючего компонента газового фонтана;
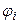 − доля i -гo горючего компонента.
− доля i -гo горючего компонента.
Действительная температура горения газового фонтана будет равна:
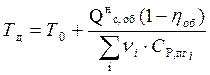 (12)
(12)
Но более точно температуру горения определяют методом последовательных приближений по известной зависимости теплосодержания (энтальпии) продуктов горения от температуры.
Если теплосодержание продуктов горения при Т =273 К принять равным нулю, то полное теплосодержание продуктов горения при Т г будет равно количеству теплоты, выделившейся в результате химической реакции.
С учетом теплопотерь
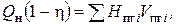 (13)
(13)
где H пг i - теплосодержание (энтальпия) i -го продукта горения.
Задача состоит в том, чтобы найти температуру, при которой будет справедливо это равенство.
Например: Найти адиабатическую температуру горения стехиометрической смеси этана с воздухом, начальная температура горючей смеси Т 0 = =273 К.
Решение. Адиабатическую температуру горения вещества находят при условии отсутствия теплопотерь (h = 0) для стехиометрической смеси горючего с воздухом, т.е. при a = 1.
|
|