
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние различных факторов на скорость распространения пламени
|
|
Нормальная скорость распространения пламени (u н) зависит от теплофизических свойств газовоздушной смеси. Но в еще большей степени скорость распространения зависит от ее физико-химических свойств − скорости горения V, и температуры в зоне реакции горения, ТГ:
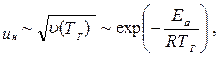 (1)
(1)
т.е. u н пропорциональна скорости реакции окисления (V) и находится в экспоненциальной зависимости от обратной температуры зоны горения (Т г). Определяющим параметром, безусловно, будет скорость реакции. Запишем уравнение скорости химической реакции горения:
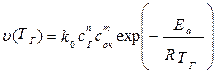 , (2)
, (2)
где k 0 – предэкспоненциальный множитель из уравнения Аррениуса,
Сг, Сок – концентрации горючего и окислителя,
m, n - порядки реакции соответственно по горючему и окислителю,
Еа - энергия активации химической реакции.
Рассмотрим, как будет меняться скорость реакций окисления для смесей с разным соотношением горючего и окислителя (рис. 2).
Из графика видно, что для смеси стехиометрического состава (коэффициент избытка воздуха a =1) скорость реакции окисления максимальна.
При увеличении концентрации горючего в смеси выше стехиометрического количества, когда a становится < 1 (кислород находится в недостатке), горючее сгорает не полностью. В этом случае меньше выделится теплоты реакции горения Qгор и произойдёт снижение T г.
Скорость реакции окисления по сравнению со стехиометрическим составом смеси уменьшится, причем как из-за снижения концентрации окислителя О2, так и температуры зоны горения. То есть при последовательном снижении a (что эквивалентно увеличению концентрации Сг в смеси) скорость реакции окисления u и температуры зоны горения Tг будут последовательно снижаться. На графике при Cг > Сгстех кривая становится резко нисходящей. Снижение же скорости реакции окисления при a > 1 объясняется уменьшением тепловыделения в зоне горения в связи с более низкой концентрацией в ней горючего.
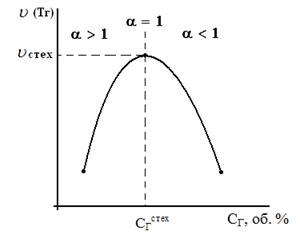
Рисунок 2. Зависимость скорости горения от концентрации горючего в смеси
Именно такая, как на рис.2, зависимость скорости реакции горения от концентрации горючего компонента в исходной смеси предопределяет параболический вид зависимости её других параметров процесса горения от состава смеси: температуры самовоспламенения и минимальной энергии зажигания, концентрационных пределов распространения пламени. Вид параболы имеет также и зависимость нормальной скорости распространения пламени u н от концентрации горючего в смеси Сг. На рис. 3 приведены такие зависимости для случая горения воздушно-пропановой смеси при различных значениях начальной температуры.
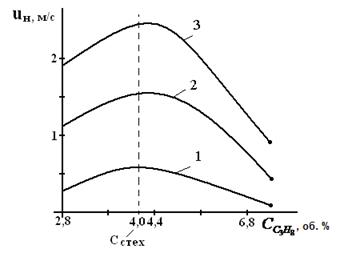
Рисунок 3. Зависимость скорости распространения пламени от концентрации пропана в воздухе при начальной температуре 311 K(1); 644 K (2); 811 K (3)
Согласно описанным выше представлениям, максимальная скорость распространения пламени (u нмах) должна соответствовать стехиометрической концентрации горючего. Однако экспериментально найденные её значения несколько сдвинуты в сторону богатых по содержанию горючих смесей. С увеличением начальной температуры смеси скорость распространения пламени должна повышаться, что и наблюдается на практике. Например, для воздушной смеси паров бензина и керосина она имеет вид, приведенный на рис. 4.
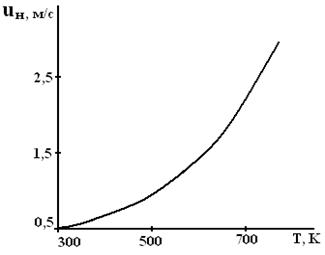
Рисунок 4. Зависимость скорости распространения пламени от начальной температуры воздушной смеси паров бензина и керосина с воздухом (a = 0.95).
Для различных веществ u н зависит от их химической природы и колеблется в довольно широких пределах (табл. 1). Для большинства смесей углеводородных топлив с воздухом uн < 1 м/с. При введении в горючую смесь избыточного воздуха или азота температура горения заметно снижается.
Таблица 1.
Нормальная скорость распространения пламени для некоторых горючих смесей
| Состав горючей смеси | Молекулярный соста | uн, м/с |
| Водород + воздух | Н2 + 0, 5(О2 + 3, 76N2) | 1.60 |
| Ацетилен + воздух | СНº СН+2, 5(О2+ 3, 76N2) | 1.50 |
| Ацетилен + кислород | СНº СН + 2, 5О2 | 8.00 |
| Этилен + воздух | СН2=СН2+3(О2 + 3, 76N2) | 0.60 |
| Бутан + воздух | С4Н10 + 6, 5(О2 + 3, 76N2) | 0.40 |
| Метан + воздух | СН4 + 3(О2 + 3, 76N2) | 0.34 |
Введение в горючую смесь инертных и нейтральных газов: азота N2, аргона Аr, диоксида углерода СО2 разбавляет ее и тем самым снижает как скорость реакции окисления, так и скорость распространения пламени. Это хорошо видно из зависимостей, приведённых на рис. 5.
При этом при определённой (флегматизирующей) концентрации разбавителей горение вообще прекращается. Наиболее сильное влияние оказывает введение хладонов, так как они обладают ещё и ингибирующим действием на реакцию горения.
Как видно из рис. 5, введение в горючую смесь хладона (114В2) в 4 – 10 раз эффективнее, чем нейтральных газов - разбавителей.
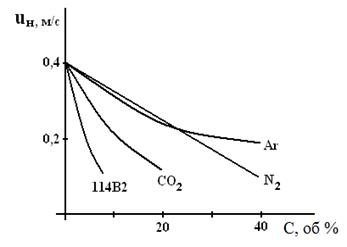
Рисунок 5. Влияние концентрации разбавителей и хладона 114В2 на скорость распространения пламени в пропано-воздушной смеси (a = 1.15)
Флегматизирующая способность газов - разбавителей зависит от их теплофизических свойств, и в частности, от их теплопроводности и теплоёмкости.
|
|