
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 3.1. Визначення константи електролітичної комірки.
|
|
Мета роботи: визначити константу комірки для вимірювання електропровідності розчинів електролітів.
Електролітична комірка (посудина для вимірювання електропровідності) – це скляна ємність, в яку зазвичай впаяно два платинованих платинових електроди. Оскільки для певної комірки невідомі площа електродів та відстань між ними, то спочатку потрібно визначити її константу – відношення відстані між електродами до їх площі:
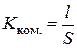 . (3.11)
. (3.11)
Для цього комірку заповнюють розчином електроліту з відомою питомою електропровідністю (зазвичай 0, 02 М розчин KCl, табл. 3.1) в такій кількості, щоб були покриті електроди, розміщують її у термостаті, який налаштовано на певну температуру, витримують протягом 8 – 10 хв. і вимірюють опір.
Таблиця 3.1. Питома електропровідність 0, 02 М розчину KCl за різних температур
| t, о С | ||||||||
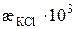 , См/см , См/см
| 2, 40 | 2, 45 | 2, 50 | 2, 55 | 2, 61 | 2, 66 | 2, 71 | 2, 77 |
Згідно з рівняннями (3.2) і (3.11) константа комірки визначається за формулою:
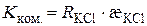 . (3.12)
. (3.12)
Звіт
1. Температура досліду: 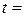 о С.
о С.
2. Питома електропровідність стандартного розчину КСl:
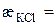 См/см.
См/см.
3. Опір стандартного розчину КСl: 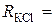 Ом.
Ом.
4. Обчислення константи комірки за рівнянням (3.12): 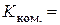 см -1.
см -1.
|
|