
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 3.4. Кондуктометричне титрування.
|
|
Мета роботи: визначити молярну концентрацію досліджуваного водного розчину електроліту кондуктометричним методом.
В основі будь-якого титрування, в тому числі й кондуктометричного, лежать іонні реакції в розчинах, які супроводжуються утворенням слабкого електроліту або осаду. Цей метод визначення концентрації розчину використовують у тих випадках, коли досліджувані системи забарвлені або каламутні і застосування кольорових індикаторів неможливе. Кондуктометричним титруванням на відміну від звичайного можна визначати окремо вміст кожної кислоти (або основи) в їх суміші, якщо зазначені компоненти суттєво відрізняються за силою.
Для визначення концентрації досліджуваного розчину до його відомого об’єму додають однакові порції титранту і вимірюють опір системи. Оскільки питома електропровідність прямо пропорційна
оберненому опору 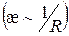 , то еквівалентну
, то еквівалентну  точку
точку 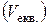 визначають за зламом на графічній залежності
визначають за зламом на графічній залежності 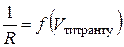 (див. рис. 3).
(див. рис. 3).
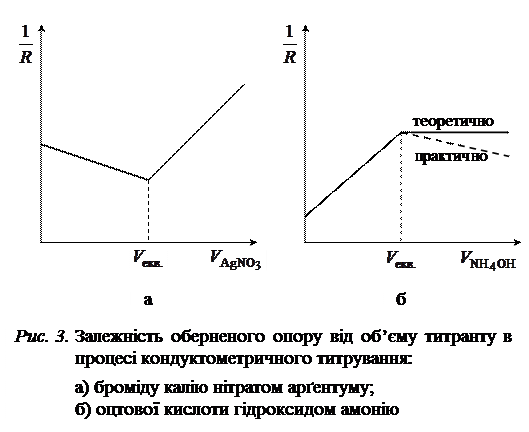
В процесі титрування розчину сильного електроліту його електропровідність до еквівалентної точки може зростати, зменшуватись або залишатися незмінною залежно від співвідношення рухливостей іонів, які замінюють один одного при додаванні титранту. Якщо досліджуваним є розчин слабкого електроліту, то до точки еквівалентності електропровідність зростає, оскільки слабкий електроліт внаслідок титрування замінюється на сильний, що призводить до збільшення кількості іонів. Після еквівалентної точки в обох випадках електропровідність зростає, якщо титрант є сильним електролітом, і теоретично не змінюється (а практично може зменшуватись внаслідок розведення розчину) в разі титрування розчином слабкого електроліту.
Наприклад, якщо розчин KBr титрувати розчином AgNO3, то внаслідок перебігу реакції
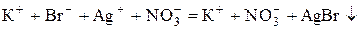
електропровідність до еквівалентної точки спадає, оскільки більш рухливі іони 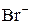 (
( См× см2/моль) поступово замінюються менш рухливими
См× см2/моль) поступово замінюються менш рухливими 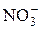 (
( См× см2/моль). Внаслідок додавання після еквівалентної точки надлишку титранту AgNO3, який є сильним електролітом, електропровідність зростає, тому що збільшується кількість іонів
См× см2/моль). Внаслідок додавання після еквівалентної точки надлишку титранту AgNO3, який є сильним електролітом, електропровідність зростає, тому що збільшується кількість іонів 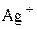 та
та 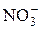 у системі (рис. 3, а).
у системі (рис. 3, а).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Якщо досліджуваним є розчин оцтової кислоти, а титрантом – розчин гідроксиду амонію, то згідно з реакцією
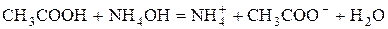
до еквівалентної точки слабкий електроліт 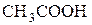 замінюється сильним – ацетатом амонію, що призводить до збільшення електропровідності, оскільки зростає концентрація іонів
замінюється сильним – ацетатом амонію, що призводить до збільшення електропровідності, оскільки зростає концентрація іонів 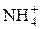 та
та 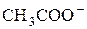 . Після еквівалентної точки внаслідок додавання надлишку малодисоційованого
. Після еквівалентної точки внаслідок додавання надлишку малодисоційованого 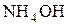 електропровідність теоретично повинна залишатися сталою, а практично вона в результаті розведення розчину зменшується (рис. 3, б).
електропровідність теоретично повинна залишатися сталою, а практично вона в результаті розведення розчину зменшується (рис. 3, б).
Для виконання роботи в кондуктометричну комірку наливають зазначений викладачем об’єм досліджуваного розчину і вимірюють його опір. Потім до комірки з бюретки послідовно додають певні об’єми титранту, перемішують і вимірюють опір після кожної наступної порції. Дані титрування записують у табл. 3.4 (див. звіт).
На основі вимірювань та обчислень будують графіки 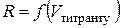 і
і
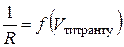 , за якими визначають еквівалентний об’єм і розраховують концентрацію титрованого розчину.
, за якими визначають еквівалентний об’єм і розраховують концентрацію титрованого розчину.
Звіт
1. Досліджуваний розчин: ___; об’єм досліджуваного розчину: 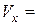 см3.
см3.
2. Титрант: ____; концентрація титранту: 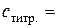 моль/дм3.
моль/дм3.
3. Рівняння реакції при титруванні:
4. Результати експерименту:
Таблиця 3.4. Результати кондуктометричного титрування
| № | 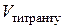 , см3 , см3
|  , Ом , Ом
| 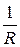 , Ом-1 , Ом-1
|
| … | |||
| 12 - 20 |
5. Побудова графіків 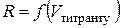 і
і 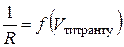 .
.
6. Визначення еквівалентного об’єму за зламом на графіку 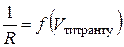 :
: 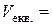 см3.
см3.
7. Обчислення концентрації досліджуваного розчину: 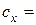 моль/дм3.
моль/дм3.
8. Висновок.
ЛІТЕРАТУРА: [1, с. 465 – 466; 2, с. 247 – 248; 3, с. 258 – 260; 5, с. 266 – 270; 6, с. 194 – 196; 7, с. 123 – 124; 8, с. 52 – 53].
|
|
