
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 2.1. Дослідження кінетики розчинення твердої кислоти у воді.
|
|
Мета роботи: визначити константу швидкості та порядок процесу розчинення твердої бензойної кислоти у воді та обчислити товщину дифузійного шару.
У склянку ємністю 500 см3 кладуть якір магнітної мішалки, наливають мірним циліндром 400 см3 дистильованої води і ставлять склянку на столик магнітної мішалки. Включають мішалку і встановлюють певну швидкість обертання якоря. Режим перемішування упродовж досліду повинен бути незмінним.
Вимірюють висоту і діаметр наплавленого на скляну паличку циліндра твердої бензойної кислоти. Після цього паличку з кислотою закріплюють на штативі над поверхнею води по центру склянки. Далі одночасно вмикають секундомір і занурюють паличку у воду таким чином, щоб рівень води у склянці був на 2 – 2, 5 см вищий за верхній торець циліндра кислоти. Кожні 8 хвилин від початку досліду 5 разів зі склянки відбирають піпеткою 10 см3 розчину бензойної кислоти і титрують його 0, 01 – молярним розчином КОН за наявності індикатора фенолфталеїну до появи малинового забарвлення. Дані експерименту записують у табл. 2.1 (див. звіт).
Для розрахунків константи швидкості процесу розчинення за формулою (2.7) необхідно знати або концентрацію насиченого розчину кислоти, або пропорційний цій концентраціїоб’єм лугу 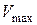 , який витрачається на титрування насиченого розчину. Для цього два – три рази до збігу результатів титрують готовий насичений розчин бензойної кислоти розчином лугу за наявності індикатора, відбираючи 10 см3 проби.
, який витрачається на титрування насиченого розчину. Для цього два – три рази до збігу результатів титрують готовий насичений розчин бензойної кислоти розчином лугу за наявності індикатора, відбираючи 10 см3 проби.
Константу швидкості процесу розчинення розраховують за формулою:
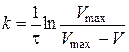 , (2.12)
, (2.12)
де 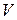 – об’єм розчину лугу, який витрачено на титрування відібраної в певний момент часу
– об’єм розчину лугу, який витрачено на титрування відібраної в певний момент часу 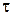 проби.
проби.
Рівняння (2.12), записане у вигляді
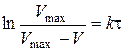 , (2.13)
, (2.13)
відповідає прямолінійній залежності 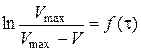 , тангенс кута нахилу якої дорівнює середній константі швидкості досліджуваного процесу:
, тангенс кута нахилу якої дорівнює середній константі швидкості досліджуваного процесу:
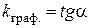 . (2.14)
. (2.14)
За експериментальними (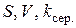 ) та довідниковими (
) та довідниковими (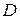 ) даними обчислюють товщину дифузійного шару
) даними обчислюють товщину дифузійного шару 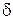 .
.
Звіт
1. Розміри циліндра бензойної кислоти:
висота 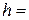 см; діаметр
см; діаметр 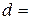 см; площа поверхні
см; площа поверхні 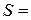 см2.
см2.
2. Результати титрування насиченого розчину бензойної кислоти:
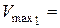 см3,
см3,  см3,
см3, 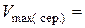 см3.
см3.
3. Результати кінетичних досліджень:
а) побудова графіка залежності 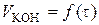 ;
;
б) обчислення за формулою (2.12) для табл. 2.1.
Таблиця 2.1. Дані для визначення константи швидкості процесу розчинення бензойної кислоти у воді та порядку цього процесу
Час від початку досліду 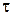 , хв. , хв.
| 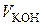 , см3 , см3
| 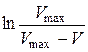
| 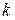 , хв.-1 , хв.-1
|
| … | |||
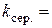 хв.-1
хв.-1
4. Побудова на основі даних табл. 2.1 графіка 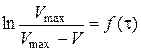 та визначення за ним (формула (2.14)) константи швидкості процесу
та визначення за ним (формула (2.14)) константи швидкості процесу
розчинення: 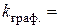 хв.-1
хв.-1
5. Розрахунок за рівнянням (2.6) товщини дифузійного шару: 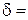 см.
см.
6. Кінетичне рівняння процесу:
7. Висновок.
ЛІТЕРАТУРА: [1, с. 531 – 532; 2, с. 384 – 393; 3, с. 341 – 343; 5, с. 225 – 233; 6, с. 276 – 277, 285 – 287; 7, с. 117; 8, с. 48].
|
|