
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема 1. Последов ателье ость атшгоа ври биохимических исследованиях Эош ассмюив» 06wt ятоаедоюм 4 страница
|
|
1) спиральная конфигурация i поли пептидной цепи, имеющая винтовую симметрию;
2) образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков;
3) регулярность витков спирали;
4) равнозначность всех аминокислотных остатков в о-спирал и независимо от строения их боковых радикалов;
5) боковые радикалы аминокислот не участвуют в образовании а-спирали.
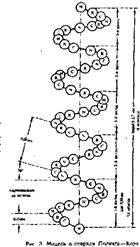
Внешне о-спираль похожа на • слегка растянутую спираль электрической плитки. Регулярность водо родных связей между первой и чет вертой пептидными группами опре деляет и регулярность витков поли пептидной цепи. Высота одного вит ка, или шаг а-спирали, р г 0, 54 нм; в него входит 3, 6 аминокислотных остатка, т. е. каждый аминокислотный'остаток перемещается вдоль оси (высота одного аминокислотного остатка) на 0, 15 нм (0, 54: 3, 6 = 0, 15 нм), что и позволяет говорить о равнозначности всех аминокислотных остатков в а-спирали. Период регулярности а-спирали равен 5 виткам или 18 аминокислотным остаткам; длина одного периода составляет 2, 7 нм.
(S-Структура. Это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидиых цепей. Ее называют также слоисто-складчатой структурой. Имеются разновидности p-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-§-формой (короткая p-структура). Водородные связи в кросс-р-форме образуются между пептидными группами петель полнпептидной цепи. Другой тип — полная р-структура — характерен для всей полнпептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 4). Эта структура напоминает меха аккордеона. Причем возможны варианты p-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и ан- тнпараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя.
В белках возможны переходы от а-структур к p-структурам и обратно вследствие перестройки водородных связей. Вместо регулярных межпептидных водородных связей вдоль цепи (благодаря им полипептидная цепь скручивается в спираль) происходит раскручивание спирализованиых участков и • замыкание водородных связей между вытянутыми фрагментами полипептидных цепей. Такой переход обнаружен в кератине — белке волей:. При мытье волос щелочными моющими средствами легко разрушается спиральная структура p-кератина н ои переходит в а-кератин (вьющиеся волосы распрямляются).
Разрушение регулярных вторичных структур белков (а-спирали и р-струк- тур) яо аналогии с плавлением Кристалла называют «плавлением» поляпеп- Тидов. При этом водородные связи рвутся, и полипептидные цепи принимают форму беспорядочного клубка. Следовательно, стабильность вторичных структур определяется межпептиднымн водородными связями. Остальные типы связей почти не принимают в этом участия, за исключением дисульфидных связей вдоль полипептидной цепи в местах расположения остатков цистеина. Короткие пептиды благодаря дисульфидным связям замыкаются в циклы.
Во многих белках одновременно имеются а-саиральные участки и р-структуры. Природных белков, состоящих на 100% из а-спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96—100% пред- ставляк> щий собой а-спираль), тогда как у синтетических полипептидов 100%-ная спирализация.
 Рис. 4. Схематическое изображение ^-структур: а — параллельные иепи; б — аитипараллельные цепи
Рис. 4. Схематическое изображение ^-структур: а — параллельные иепи; б — аитипараллельные цепи
|
Другие белки имеют неодинаковую степень спирализации. Высокая частота а-спнральных структур наблюдается у парамиозинз, миоглобииа, гемогло
бина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые p-структуры. Белкн опорных тканей: кератин {белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют р-конфигурацию полипептндных цепей.
Разная степень спирализации полипептидных цепей белков говорит о том, что, очевидно, имеются силы, частично нарушающие спирализацню или «ломающие» регулярную укладку полипептидной цепи. Причиной этого является более компактная укладка полипептидной цепи белка в определенном объеме, т. е. в третичную структуру.
Третичная структура 5*дка
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные я фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация.третичной структуры белков еще не дает основания думать, что фибриллярные белкн имеют только p-структуру, а глобулярные а-спиральные. Есть фибриллярные белкн, имеющие спиральную, а не слоисто» складчатую вторичную структуру. Например, а-кератин и парамиознн (белок запирательной мышцы моллюсков), тропомиозины (белкн скелетных мышц) относятся к фибриллярным белкаМ (имеют палочковидную форму), а вторичная структура у них— а-спираль; напротив, в глобулярных белках может быть- большое количество р-структур.
Спирализация линейной полипептндноя цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на сильные {ковалентные) и слабые (полярные, ван-дер-ваальсовы). <,
Кковалентным связям относятся дисульфидные связи (—S—S—) между боковыми радикалами цистеинов, находящихся в разных участках по-.липептидной цепи; изопептидные, или псевдопептидные, — между аминогруппами боковых радикалов лизина, аргинина, а не а-аминогруппами, и СООН- группами боковых радикалов аспарагиновой, глутаминовой и аминолимонной кислот, а не а-карбоксильнымн группами аминокислот. Отсюда и название этого типа < вязи — подобная пептидной., Редко встречается эфирная связь, образуемая СООН-груплой днкарбоновых аминокислот (аспарагиновой, глутаминовой) и ОН-группой гидроксиаминокнслот (серина, треонина).
К полярным связям относятся водородные и ионные. Водородные связи, как обычно, возникают между группой —NH2, — ОН или —SH бокового радикала одной аминокислоты и карбоксильной группой другой. Ионные, или электростатические, связи образуются при контакте заряженных групп боковых радикалов —NHt (лизина, аргинина, гистиднна) и —СОО- (аспарагиновой н глутаминовой кислот).
Неполярные, или ван-дер-ваальсовы, связи образуются между углеводородными радикалами аминокислот. Гидрофобные радикалы аминокислот аланина, валина, - изолейцина, метионина, фенилаланина в водной среде взаимодействуют друг с другом. Слабые ван-дер-ваальсовы связи способствуют формированию гидрофобного ядра из неполярных радикалов внутри белковой глобулы. Чем больше неполярных аминокислот, тем большую роль в укладке полипептидной цепи играют ван-дер-ваальсовы связи.
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы.
Особенности организации третичной структуры белка. Конформацня третичной структуры полипептидной цепи определяется свойствами боковых радикалов входящих в нее аминокислот (которые не оказывают заметного влияния на формирование первичной и вторичной структур) и микроокружением, т. е. средой. При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому неполярные R-группы, «избегая» воды, образуют как бы внутреннюю часть третичной структуры белка, где расположена основная часть гидрофобных остатков полипептидной цепи. В центре белковой глобулы почти нет молекул воды. Полярные (гидрофильные) R-группы аминокислоты располагаются снаружи этого гидрофобного ядра и окружены молекулами воды. Полипептидная цепь причудливо изгибается в трехмерном пространстве. При ее изгибах нарушается вторичная спиральная конформация. «Ломается» цепь в слабых точках, где находятся пролин или гидроксилролин, поскольку эти аминокислоты более подвижны в цепи, образуя только одну водородную связь с другими пептидными группами. Другим местом изгиба является глицин, R-группа которого мала (водород). Поэтому R-группы других аминокислот при укладке стремятся занять свободное пространство в месте нахождения глииина. Ряд аминокислот — аланин, лейцин, глутамат, гистидив — способствуют сохранению устойчивых спиральных структур в белке, а такие, как метионин, валин, изолейцин, аспарагиновая кислота, благоприятствуют образованию p-структур. В молекуле белка с третичной конфигурацией встречаются участки в виде а-спиралей (спирализованные), Ц-структур (слоистые) и беспорядочного клубка. Только правильная пространственная укладка белка делает его активным; нарушение ее приводит к изменению свойств белка и потере биологической активности.
Четвертичная структура белка
Белки, состоящие из одной полипептидной цепн, имеют только третичную структуру. К ним относятся миоглобин — белок мышечной тка.ни, участвующий в связывании кислорода, ряд ферментов (лизоцим, пепсин, трипсин и т. д.). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет третичную структуру. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой — протомсрожи или субъединицачи (рис. 5).
При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, гемоглобин — белок, имеющий четвертичную структуру, состоит из четырех 40
Рис. 5. Схема третичной (а) и четвертичной (б) структуры белка субъеднннц. Каждая из субъединиц — глобулярный белок и в целом гемоглобин тоже имеет глобулярную конфигурацию. Белки волос и шерсти — кератины, относящиеся по третичной структуре к фибриллярным белкам, имеют фибриллярную конформацию и четвертичной структуры.
Стабилизация четвертичной структуры белков. Все белки, у которых обнаружена четвертичная структура, выделены в ниде индивидуальных макромолекул, не распадающихся на субъедииицы. Контакты между поверхностями субъединиц возможны только за счет полярных групп аминокислотных остатков, поскольку при формировании третичной структуры каждой из полипептидных цепей боковые радикалы неполярных аминокислот (составляющих бблыиую часть всех протеиногенных аминокислот) спрятаны внутри субъедииицы. Между их полярными группами образуются многочисленные ионные (солевые), водородные, а в некоторых случаях и дясульфидные связи, которые прочно удерживают субъединицы в виде организованного комплекса. Применение веществ, разрывающих водородные связи, или веществ, восстанавливающих дисульфидные мостики, вызывает дезагрегацию протомеров и разрушение четвертичной структуры белка. В табл. 8 суммированы данные о связях, стабилизирующих разные уровни организации белковой молекулы.
Особенности структурной организации некоторых
фибриллярных белков
Структурная организация фибриллярных белков имеет ряд особенностей по сравнению с глобулярными белками. Эти особенности можно проследить на примере кератина, фиброина и коллагена. Кератины существуют в а- и Р-конформациях. а-Кератнны и фиброин имеют слоисто-складчатую вторичную структуру, однако в кератине цепи параллельны, а в фиброине анти- параллельны (см. рис. 4); кроме того, в кератине имеются межцепочечные дисульфидные связи, а у фиброина они отсутствуют. Разрыв дисульфидяых связей приводит к разъединению полипептидных цепей в кератинах. Напротив, образование максимального числа дисульфидных связей в кератинах путем воздействия окислителей создает прочную пространственную структуру.
Вообще у фибриллярных белков в отличие от глобулярных порой трудно строга разграничить разные уровни организации. Если принять (как для глобулярного белка), что третичная структура должна образовываться путем укЛадки в пространстве одной полипептнднон цепи, а четвертичная — не-
T j б л и ц J 8 Характеристика связен, участвующих в структурной организации белков
|
Ькольких цепей, то в фибриллярных белках уже при формировании вторичной •структуры участвует несколько полипептидных цепей. Типичным примером фибриллярного белка является коллаген, который относится к самым распространенным белкам организма человека (около '/з от массы всех белков). Он содержится в тканях, обладающих высокой прочностью и малой растяжимостью (кости, сухожилия, кожа, зубы и т. д.). В коллагене треть аминокислотных остатков приходится на глицнн, а около четверти нлн чуть более —; на пролин или гидроксяпролнн.
Изолированная поляпептндная цепь коллагена (первичная структура) похожа на ломаную линию. Она содержит около 1000 аминокислот и имеет молекулярную массу порядка 106 (рис. 6, а, б). Полипептидная цепь построена нз повторяющейся тройки аминокислот (триплет) следующего состава: гли—А—В, где А и В — любые, кроме глицина, аминокислоты (чаитч всего пролин и гидрбксипролин). Полипептидные цепи коллагена (или а-цепн) при формировании вторичной и третичной структур (рис. 6, в и г) не могут давать типичных о-спиралей, имеющих винтовую симметрию. Этому мешают пролин, гидроксипролин и глицин (аитиспирэльные аминокислоты). Поэтому три а-це- пи образуют как бы скрученные спирали подобно трем нитям, обвивающим цилиндр. Три спиральные а-цепи формируют повторяющуюся структуру коллагена, которая называется тропоколлагеном (рис. 6, г)..Тропоколлаген по своей
организации является третичной структурой коллагена. Плоские кольца пролнна и оксипролнна, регулярно чередующиеся вдоль цепи, придают ей жесткость, как и межцепочечные связи между а-це- пями тропоколлагена (поэтому коллаген устойчив к растяжению). Тропоколлаген является, по существу, субъединицей фибрилл коллагена. Укладка тропоколлагеновых субъединиц в четвертичную структуру коллагена происходит ступенеобразно (рис. 6, д).
Стабилизация структур коллагена происходит за счет межцепочечных водородных, ионных и ван-дер-ваальсовых связей и небольшого количества ковалентных связей.
а-Цепи коллагена имеют разное химическое строение. Различают al-цепи разных видов (I, II, III, IV) и а2-цепи. В зависимости от того, какие al- й о2-цепи участвуют в образовании трехцепочечной спи- а рали тропоколлагена, различают четыре типа КОЛЛагена: Рис. 6. Схема структурной организации коллагена первый тип — две al (I) и одна < по Уа6тУ " а2-цели; второй тип — три
а1(И)-цепи; третий тип — три al (Ш)-цепи; 'четвертыЙ тип — три al(lV)-ue- пи. Наиболее распространен коллаген первого типа: он содержится в костной ткани, ко> ке, сухожилиях; коллаген второго тнпа содержится в хрящевой ткани и т. д. В одном виде ткани могут быть разные типы коллагена.
Упорядоченная агрегация коллагеновых структур, их жесткость и инертность обеспечивают высокую прочность коллагеновых волокон. Коллагеновые белки содержат также углеводные компоненты, т. е. являются белок-углеводными комплексами.
Коллаген — внеклеточный белок, который образуется клетками соединительной ткани, входящей во все органы. Поэтому с повреждением коллагена (или нарушением его образования) возникают множественные нарушения опорных функций соединительной ткани органов.
| н | |
|

|
4. Физико-химические свойства белков Аминокислотный состав и пространственная организация каждого белка определяют его физико-химические свойства. Белкн обладают кислотно-основными, буферными, коллоидными и осмотическими свойствами.
Белки как амфотерные макромолекулы
Белки являются амфотерными полиэлектролитами, т. е. сочетают в себе, подобно аминокислотам, кислотные и основные свойства. Однако природа групп, придающих амфотерные свойства белкам, далеко не та же, что у аминокислот. Кислотно-основные свойства аминокислот обусловлены прежде всего наличием о-амино- и а-карбоксильной групп (кислотно-основная пара). В молекулах белков эти группы участвуют в образовании пептидных связей, а амфотер- ность белкам придают кислотно-основные группы боковых радикалов амино- кислот" входящих в белок. Разумеется, в каждой молекуле нативного белка (полипептидной цепи) имеется как минимум по одной концевой а-амино- и а-карбоксильной группе (если у белка только третичная структура). У белка с четвертичной структурой число концевых групп —NH2 н —COOK равно числу субъединиц, или протомеров. Однако столь незначительное число этих групп не может объяснить амфотерность макромолекул белка. Поскольку ббльшая часть полярных групп находится на поверхности глобулярных белков, то именно они определяют кислотно-основные свойства и заряд белковой молекулы. Кислотные свойства белку придают кислые аминокислоты (аспарагиновая, глутдмииовая и аминолимониая), а щелочные свойства — основные аминокислоты (лизин, аргинин, гистидин). Чем больше кислых аминокислот содержится в белке, тем ярче выражены его кислотные свойства, и чем больше.входит в состав белка основных аминокислот, тем сильнее проявляются его основные свойства. Слабая диссоциация SH-группы цистеина и фенольной группы тирозина (их можно рассматривать как слабые кислоты) почти не влияет на амфотерность белков.
Буферные свойства. Белки хотя и обладают свойствами буфера, но емкость их при физиологических-значениях рН ограничена. Исключение составляют белки, содержащие много гистидина, так как только боковая группа гистидина обладает буферными свойствами в интервале значений рН, близких к физиологическим. Таких белков очень мало. Гемоглобин чуть ли не единственный белок, содержащий до 8% гистидина, является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне.
Заряд белковой молекулы зависит от содержания в ней кислых и основных аминокислот, а точнее, от ионизации кислых и основных групп бокового радикала этих аминокислот. Диссоциация СООН-групп кислых аминокислот вызывает появление отрицательного заряда на поверхности белка, а боковые радикалы щелочных аминокислот несут положительный заряд (за счет присоединения Н+ к основным группам). В нативной молекуле белка заряды распределяются асимметрично в зависимости от укладки полипептндной цепи в пространстве. Если в белке кислые аминокислоты преобладают над основными, то в целом молекула белка электроотрицательна, т. е. является полианионом, и наоборот, если преобладают основные аминокислоты, то она заряжена положительно, т. е. ведет себя как поликатион.
Суммарный заряд белковой молекулы, естественно, зависит от рН среды: в кислой среде он положителен, в щелочной отрицателен. То значение рН, при котором белок имеет суммарный нулевой заряд, называется изоэлектри- ческой точкой данного белка. В этой точке белок не.обладает подвижностью в электрическом поле. Изоэлектрическая точка каждого белка определяется соотношением кислых и основных групп боковых радикалов аминокислот: чем выше соотношение кислые/основные аминокислоты в белке, тем ниже его изоэлектрическая точка. У кислых белков pHi< 7, у нейтральных рН[ около 7, а у основных pHi^»7. При значениях рН среды ниже его изоэлектрической точки белок будет нести положительный заряд, а выше — отрицательный заряд. Усредненная изоэлектрическая точка всех белков цитоплазмы лежит в пределах 5, 5. Следовательно, при физиологическом значении рН (около 7, 0— 7, 4) клеточные белки имеют общий отрицательный заряд. Избыток отрицательных зарядов белков внутри клетки уравновешивается, как уже говорилось, неорганическими катионами.
Знание изоэлектрической точки очень важно для понимания стабильности белков в растворах, так как в изоэлектрическом состоянии белки наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Коллоидные и ос мот ячеек ие свойства белков
Поведение белков в растворах имеет некоторые особенности. Обычные коллоидные растворы устойчивы только в.присутствии стабилизатора, который препятствует осаждению коллоидов, располагаясь на границе раздела «растворенное вещество — растворитель».
Водные растворы белков являются устойчивыми и равновесными, они со временем не выпадают в осадок (не коагулируют) и не требуют присутствия стабилизаторов. Белковые растворы гомогенны и, в сущности, их можно отнести к истинным растворам. Однако высокая молекулярная масса белков придает их растворам многие свойства коллоидных систем:
1) характерные оптические свойства (опалесценция растворов и способность их рассеивать лучи видимого света);
2) малая скорость диффузии;
3) неспособность проникать через полупроницаемые мембраны;
4) высокая вязкость растворов;
5) способность к образованию гелей.
Оптические свойства белков. Растворы белков, особенно концентрированные, обладают характерной опалесцениией. При боковом освещении раствора белка лучи света в нем становятся видимыми и образуют светящийся конус или полосу1— эффект Тиндаля (в сильно разбавленных растворах белка ие видна опалесценция и почти отсутствует светящийся конус Тиндаля). Объясняется этот светорассеивающий эффект дифракцией лучей света частицами белка в растворе. Считается, что в протоплазме клетки белок находится в виде коллоидного раствора — золя. Способность белков и других биологических молекул (нуклеиновых кислот, полисахаридов и т. д.) рассеивать свет используется при микроскопическом изучении клеточных структур: в темном поле микроскопа коллоидные частицы видны как светлые вкрапления в цитоплазме.
, Светорассеивающую способность белков и других высокомолекулярных веществ используют для их количественного определения методом нефелометрии, сравнивая интенсивность светорассеивания взвешенными частицами ис- бледуемого и стандартного золя.
Малая скорость диффузии. Диффузией называется самопроизвольное перемещение молекул растворенных веществ вследствие градиента концентраций (от зон с высокой концентрацией к зонам с низкой концентрацией). Белки имеют ограниченную скорость диффузии в сравнении с обычными молекулами и ионами, которые перемещаются в сотни и тысячи раз быстрее, чем белки. Скорость диффузии белков больше зависит от формы их молекул, чем от молекулярной массы. Глобулярные белки в водных растворах подвижнее фибриллярных белков..
Диффузия белков имеет важное значение для нормального функционирования клетки. Синтез белков в любом участке клетки (там, где имеются рибосомы) мог бы привести при отсутствии диффузии к скоплению' белков в месте их образования. Внутриклеточное распределение белков происходит путем диффузии. Поскольку скорость диффузии белков невысока, она ограничивает скорость процессов, зависящих от функции диффундирующего белка в соответствующем участке клетки.
Осмотические свойства белков'. Белкн из-за высокой молекулярной массы не могут диффундировать через полупроницаемую мембрану, тогда как ннзко- молекулярные вещества легко проходят через такие мембраны. Это свойство белков используют в практике для очистки их растворов от низкомолекулярных примесей. Такой процесс называется диализом.
Неспособность белков диффундировать через полупроницаемые мембраны вызывает явление осмоса, т. е. перемещение молекул воды через полупроницаемую мембрану в раствор белка. Если раствор белка отделить от воды целлофановой мембраной, то, стремясь к достижению равновесия, молекулы воды диффундируют в раствор белка. Однако перемещение воды в пространство, где находится белок, повышает в нем гидростатическое давление (давление столба воды), которое препятствует дальнейшей диффузии молекул воды к белку.
То давление, или сила, которое следует " приложить, чтобы остановить осмотический ток воды, называется осмотическим давлением. Осмотическое давление в очень разбавленных растворах белка пропорционально молярной концентрации белка и абсолютной температуре.
Биологические мембраны также непроницаемы для белка, поэтому осмотическое давление, создаваемое.белком, зависит от концентрации его внутри и вне клетки. Осмотическое давление, обусловленное белков, называют также онкотическим давлением.
Высокая вязкость растворов белка. Высокая вязкость характерна не толь- - ко для растворов белка, но вообще для растворов высокомолекулярных соединений. С увеличением концентрации белка вязкость раствора повышается, поскольку повышаются силы сцепления между молекулами белка. Вязкость зависит от формы молекул. Растворы фибриллярных белков всегда более вязки, чем растворы глобулярных белков. На вязкость растворов сильно влияют температура и присутствие электролитов. С повышением температуры вязкость растворов белка снижается. Добавки некоторых солей, например кальция, повышают вязкость, способствуя сцеплению молекул с помощью кальциевых мостиков. Иногда вязкость белкового раствора увеличивается настолько, что он теряет текучесть и переходит в гелеобразное состояние.
Способность белков к образованию гелей. Взаимодействие между макромолекулами белка в растворе может привести к образованию структурных сеток, внутри которых находятся захваченные молекулы воды. Такие структурированные системы называются гелями или студнями. Считается, что белок протоплазмы клетки может переходить в гелеобразное состояние. Характерный пример — тело медузы является как бы живым студнем, содержание воды в котором до 90%.
Гелеобразование легче протекает в растворах фибриллярных белков: их палочковидная форма способствует лучшему контакту концов макромолекул. Это хорошо известно из бытовой практики. Пищевые студни готовят из продуктов (кости, хрящи, мясо), содержащих в большом количестве фибриллярные белки.
' В процессе жизнедеятельности организма гелеобразное состояние белковых структур имеет важное физиологическое значение. Коллагеновые белки костей, сухожилий, хрящей, кожи и т. д. обладают высокой прочностью, упругостью и эластичностью, потому что находятся s гслсобразпом состоянии. Отложение минеральных солей при старении снижает их упругость и эластичность. В гелеобразном или студнеобразном виде находится в мышечных клетках актомиозин, выполняющий сократительную функцию.
В живой клетке происходят процессы, напоминающие переход золь — гель. Протоплазма клетки представляет собой золеподобную вязкую жидкость, в которой обнаруживаются островки гелеподобных структур.
Гидратация белков и факторы, влияющие на их растворимость
Белки — гидрофильные вещества. Если растворять сухой белок в воде, то сначала он, как всякое гидрофильное высокомолекулярное соединение, набухает, а затем молекулы белка начинают постепенно переходить в раствор. При набухании молекулы воды проникают в белок и связываются с его полярными группами. Плотная упаковка полипептидных цепей разрыхляется. Набухший белок можно считать как бы обратным раствором, т. е. раствором молекул воды в высокомолекулярном веществе — белке. Дальнейшее поглощение воды приводит к отрыву молекул белка от общей массы и растворению. Но набухание не всегда ведет к растворению; некоторые бе/рси, например коллаген, так и остаются в набухшем виде, поглотив большое количество воды.
|
|