
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Исходный уровень знаний. 1. Знание теории электролитической диссоциации, особенно
|
|
1. Знание теории электролитической диссоциации, особенно
свойств растворов слабых электролитов.
2. Знание ионного произведения воды, рН.
3. Умение рассчитывать рН растворов слабых электролитов.
После изучения темы студент должен:
— знать:
– сущность гидролиза солей;
– причину и следствие гидролиза;
– значение гидролиза в биологии и медицине (гидролиз АТФ, жиров, белков);
— уметь:
– писать уравнение реакции гидролиза любой соли в ионной и молекулярной форме;
– на основе уравнения реакции писать константу гидролиза;
– рассчитывать величину рН среды раствора соли заданной концентрации.
Учебно-целевые вопросы:
1. Определение и сущность гидролиза.
2. Причина и следствие гидролиза.
3. Гидролиз солей одноосновных кислот и однокислотных оснований (уравнение в молекулярном и ионном виде, рН среды, вывод константы гидролиза (Кг) и связь ее с константой диссоциации слабого электролита, образующегося при гидролизе):
– гидролиз солей слабых кислот и сильных оснований,
– гидролиз солей слабых оснований и сильных кислот,
– гидролиз солей слабых кислот и слабых оснований.
4. Гидролиз солей многокислотных оснований и многоосновных кислот:
– гидролиз солей слабой многоосновной кислоты и сильного основания,
– гидролиз солей слабых многокислотных оснований и сильной кислоты,
– гидролиз солей слабого многокислотного основания и многоосновной слабой кислоты.
5. Факторы, влияющие на процесс гидролиза
- температура
- концентрация
- добавление кислоты, основания
6. Смещение равновесия гидролиза
7. Роль гидролиза в биохимических процессах. Гидролиз АТФ как универсальный источник энергии в организме.
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
1. Причина и следствие гидролиза
2. Какова реакция среды в растворах солей нитрата кальция, цианида аммония, ацетата бария?
3. Какая из солей подвергается гидролизу в большей степени и почему: ацетат или цианид калия?
4. Как связана константа гидролиза соли с константой диссоциации слабого электролита,
образующегося в результате гидролиза?
5. Всегда ли степень гидролиза зависит от концентрации раствора соли?
6. Как связаны между собой степени гидролиза и константа гидролиза?
7. Какова реакция среды растворов гидрофосфата натрия и дигидрофосфата натрия?
8. В каких случаях реакция гидролиза соли идет до конца?
9. Почему гидролиз АТФ можно рассматривать как универсальный источник энергии?
10. Найти степень гидролиза и рН в 0, 001М растворе ацетата калия. (Кукс. к-ты= 1, 75·10–5.)
Ответ: α =7, 5·10–4, рН =7, 88.
11. При помощи фенолфталеина можно различить растворы солей …
1) ZnSO4 и Fe(NO3 )2 2) K2SO4 и CuCl2 3) Na 2CO3 и K2S 4) K2CO3 и KCl
12. Для усиления гидролиза карбоната калия в водном растворе необходимо
1) увеличить температуру 2) добавить щелочи
3) увеличить концентрацию соли 4) уменьшить температуру
13. Энергия, выделяющаяся в результате распада веществ (катаболизма), запасается в макроэнергетических связях молекул …
1) АТФ 2) углеводов 3) аденина 4) липидов
14. В уравнении для расчёта константы гидролиза ацетата натрия не учитывается значение концентрации …
1) [CH3COOH] 2) [Na+] 3) [CH3COO] 4) [OH–]
15. Необратимому гидролизу (с образованием исходной кислоты и основания) подвергается:
1) хлорид натрия;
2) ацетат калия;
3) сульфид алюминия;
4) цианид натрия;
16. Уравнение для расчета Кг соли, образованной сильной одноосновной кислотой и слабым однокислотным основанием это:
1) 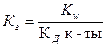 ; 2)
; 2) 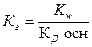 ; 3)
; 3) 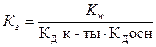 ; 4)
; 4) 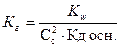
17. Гидролиз и диссоциация кислотного остатка протекает одновременно в случае:
1) NH4ClO4 2) NaNO2 3) NaHSO3 4) ZnSO4
18. Уравнение для расчета степени гидролиза (h) соли, образованной одноосновной сильной кислотой и однокислотным слабым основанием (NH4Cl, NH4NO3):
1) h = 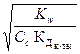 2) h =
2) h = 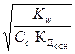 3) h =
3) h = 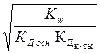 4) h =
4) h = 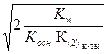
19. Среда водного раствора хлорида аммония:
1) слабощелочная; 2) кислая; 3) нейтральная; 4) сильнощелочная
20. Уравнение: 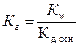 справедливо для соли:
справедливо для соли:
1) NH4CH3COO; 2) NH4NO3; 3) NaCN; 4) KCl
Задания для самоконтроля (включены в коллоквиум и зачетное занятие)
1. Сокращённое ионное уравнение HCO3- + H2O «Н2СО3 + ОН- соответствует гидролизу соли::
1) КCH3COO 2) Nа2CO3 3) КHCO3 4) ZnCO3
2. Формула 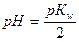 соответствует гидролизу соли:
соответствует гидролизу соли:
1) KF 2) NаNO3 3) NH4CH3COO 4) MgCl2
3. Гидролизу не подвергается соль:
1) ZnSO4 2) K2S 3) NaBr 4) K2HPO4
4. Уравнение для расчёта 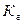 соли, образованной слабым основанием и слабой одноосновной кислотой это:
соли, образованной слабым основанием и слабой одноосновной кислотой это:
1) 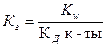 2)
2) 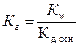 3)
3) 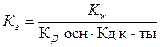 4)
4) 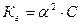
5. Усилить гидролиз соли NaCH3COO можно добавление:
1) NaOH 2) KCN 3) HCl 4) KCl
6. Кислую среду, имеет водный раствор:
1) KCl 2) Nа2S 3) NH4CH3COO 4) FeCl3
7. Формула 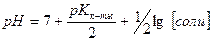 применима для соли:
применима для соли:
1) Na2CO3 2) NH4ClO4 3) ZnSO4 4) NH4CN
8. Ослабление гидролиза соли KNO2 происходит при добавлении:
1) NaOH 2) повышение температуры 3) HCl 4) KCl
9. Нейтральную среду имеет водный раствор соли:
1) KClO 2) KNO2 3) Mg(NO3)2 4) NH4CH3COO
10. Гидролизу соли, образованной слабой кислотой и сильным основанием, отвечает уравнение:
1) СН3СОО- + Н2О «СН3СООН + ОН- 2) NH4 + H2O «NH4OH + H+
3) NH4+ + CH3COO- + H2O «NH4OH + CH3COOH 4) Al3+ + H2O «AlOH2+ + H+
11. Уравнение для расчета рН соли образованной слабой одноосновной кислотой и однокислотным сильным основанием (NaCN, CH3COOК, KNO2
1) рН = 7 + ½ рКк + ½ lgCc 2) рН = 7 + ½ рКк - ½ pKосн
3) рН = 7 - ½ рКосн - ½ lg Cc 4) рН = 7 + ½ рКк + ½ рКосн - ½ lg2
12. Усилить гидролиз соли KCN можно добавлением:
1) NaOH 2) KCl 3) HCl 4) CH3COONa
13. Гидролиз соли, образованной сильной кислотой и слабым основанием, соответствует уравнению:
1) HCOO- + HOH «OH- + HCOOH 2) NH4+ + HOH «H+ + NH4OH
3) NH4+ + CN- + HOH «NH4OH + HCN 4) Al3+ + 3CH3COO- + HOH «AlOH(CH3COO)- + CH3COOH
14. Не подвергаются гидролизу соль:
1) Na2S 2) AlCl3 3) NaNO3 4) Na2CO3
15. Гидролиз АТФ в организме - источник:
1) ионов водорода 2) белков 3) воды 4) энергии
16. Ослабить гидролиз соли NH4NO3 можно добавлением:
1) NaOH 2) NaCl 3) HCl 4) NaCN
17. Уравнение h = 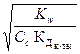 справедливо для соли, образованной:
справедливо для соли, образованной:
1) одноосновной сильной кислотой и однокислотным слабым основанием
2) однокислотным сильным основанием и одноосновной слабой кислотой
3) однокислотным слабым основанием и одноосновной слабой кислотой
4) однокислотным слабым основанием и многоосновной сильной кислотой
18. Гидролиз соли NaСN протекает с образованием среды:
1) щелочной 2) нейтральной 3) слабо кислой 4) сильно кислой
19. Соль Nа2S гидролизуется:
1) по катиону 2) по аниону 3) по катиону и аниону 4) не протекает
20. При гидролизе кислых солей учитывается:
1) только гидролиз 2) только диссоциация кислого иона
3) гидролиз и диссоциация 4) гидратация ионов
|
|