
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Исходный уровень знаний. 1. Знание основных химических понятий: моль, молярная масса, относительная молекулярная масса, эквивалент
|
|
1. Знание основных химических понятий: моль, молярная масса, относительная молекулярная масса, эквивалент, фактор эквивалентности.
2. Знание закона эквивалентов.
3. Умение рассчитывать концентрацию растворов и массовые доли (процентное содержание) веществ.
После изучения темы студент должен:
— знать:
– понятие о титриметрических методах;
– титрованные растворы (титр приготовленный, титр установленный, исходные вещества);
– рабочие растворы и исследуемые вещества в методах титриметрического анализа;
— уметь:
выбирать метод титриметрического анализа при исследованиях;
– выбирать исходные вещества для данного метода;
– проводить расчеты титра, нормальной концентрации, процентного содержания определяемого вещества.
Учебно-целевые вопросы:
1. Предмет и разделы аналитической химии. Качественный и количественный анализ.
2. Титриметрический анализ, его методы и задачи.
3. Классификация методов титриметрического анализа.
4. Требования к реакциям, применяемым в титриметрическом анализе.
5. Титрованные растворы:
– титр,
– титр приготовленный и титр установленный,
– исходные вещества и требования, предъявляемые к ним,
– рабочие растворы и исследуемые вещества.
6. Расчеты в титриметрическом анализе:
– способ, основанный на законе эквивалентов,
– способ, основанный на следствии из закона эквивалентов.
7. Значение титриметрического анализа в медико-биологических исследованиях.
Вопросы и задания для самоподготовки
(обязательные домашние задания, выполняемые в отдельной тетради)
1. Титриметрический анализ, его задачи и методы
2. Требования к аналитическим реакциям в титриметрическом анализе
3. Титр, титр приготовленный, титр установленный
4. Исходные вещества и требования к ним
5. Рабочие растворы и определение их титра и нормальности
6. Исследуемые (определяемые) вещества
7. Расчеты в титриметрическом анализе
8. Что такое рабочий раствор?
9.. Как определить титр и нормальность рабочего раствора?
10. Как точно измерить объем раствора?
11. В чем состоит задача количественного анализа?
12. Какой смысл заключен в выражениях 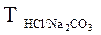 ;
;  ?
?
13. Что такое точка эквивалентности и как она фиксируется?
14. Чему равен титр 1, 000н раствора гидроксида натрия?
15. Вычислить молярную концентрацию 10% раствора аммиака (пл. 0, 958 г/см3)
Задания для самоконтроля (включены в коллоквиум и зачетное занятие)
1. Титр показывает сколько:
1) граммов вещества содержится в 1 мл раствора
2) граммов вещества содержится в 1 л раствора
3) моль вещества содержится в 1 л раствора
4) моль вещества содержится в 100 г раствора
2. Состояние эквивалентности – это:
1) изменение окраски индикатора вблизи точки нейтральности
2) число моль - эквивалента определяемого вещества равно числу моль – эквивалента рабочего раствора
3) рН среды должно быть равно 7
4) совпадение точек нейтральности и эквивалентности
3. Титрование-это:
1) контролируемое добавление рабочего раствора (титранта) к анализируемой системе
2) добавление раствора анализируемого вещества к раствору известной концентрации
3) произвольное приливание стандартного раствора в присутствии индикатора до изменения окраски
4) добавление раствора анализируемого вещества к раствору неизвестной концентрации
|
|