
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Белки животных, участвующие в NER
|
|
| Белковая система | Белки системы | Ферментативная активность | Функция в репарации |
| XPA | XPA (p31) | Связывание ДНК | Распознавание повреждения |
| RPA | p70 p34 p11 | То же | То же |
| TFIIH | XPB/ERCC3 (p89) XPD/ERCC2 (p80) р62 р44 Cdk7 (p41) CycH (p38) p34 | ДНК-зависимая АТРаза Локальное расплетание ДНК Фактор транскрипции Киназа, активирующая Cdk | Образование преинцизионного комплекса Сопряжение транс - крипции и репарации |
| XPC | XPC (p125)/ HHR23B (p112) | Связывание ДНК | ? |
| XPF | XPF/ERCC4 (p112) ERCC1 (p33) | Эндонуклеаза | 5’-Концевое надреза-ние ДНК |
| XPG | XPG/ERCC5 (p135) | » | 3’-Концевое надреза-ние ДНК |
белков в очищенном состоянии, могут не иметь прямого отношения к их функциям в системе NER.
XPA – белок с молекулярной массой 31 кДа, обладает доменом типа " цинковые пальцы", участвует в распознавании поврежденного участка ДНК. Он также взаимодействует с другими компонентами системы и может функционировать в качестве фактора нуклеации для экзонуклеазы. XPA взаимодействует своим N-концевым доменом с гетеродимером ERCC1–XPF, а С-концевым доменом – с TFIIH. Кроме того, белок RPA (HSSB) образует комплекс с XPA и усиливает его специфичность в отношении поврежденной ДНК.
RPA (HSSB) – тример, состоящий из белковых субъединиц р70, р34 и р11, необходим для репликации ДНК и репаративного синтеза, а также для прохождения этапа двойного надреза ДНК во время эксцизионной репарации. Он обладает умеренным сродством к поврежденной ДНК.
TFIIH – олигомерный комплекс, в состав которого входят белки р89, р80, р62, р44, р41, р38 и р34. Этот белковый комплекс первоначально был открыт как один из семи основных факторов транскрипции, необходимых для эффективного функционирования РНК-полимеразы II. Случайно было установлено, что его субъединица р89 идентична белку репаративного комплекса XPB, а также обнаружено отсутствие функциональной комплементации между бесклеточными экстрактами клеток с мутантными белками XPB и XPD, определяемой по восстановлению репарирующей активности в смешанных экстрактах. Все это привело к пониманию того, что весь комплекс TFIIH представляет собой фактор репаративной системы. Белки XPB и XPD являются ДНК-зависимыми АТРазами, обладают так называемыми хеликазными доменами и могут (как и сам фактор TFIIH) вызывать диссоциацию гибридов, образованных между короткими фрагментами ДНК и одноцепочечной ДНК.
XPC – белок с молекулярной массой ~125 кДа, существует в виде гетеродимера в комплексе с белком р58, который является гомологом белка Rad23 дрожжей (HHR23B). XPC слабо связывается с TFIIH и очень прочно – с одноцепочечной ДНК.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
ERCC1/XPF – чрезвычайно прочный белковый комплекс, с которым взаимодействует белок XPA. Он обладает эндонуклеазной активностью, специфичной в отношении одноцепочечной ДНК.
XPG – белковый комплекс, обладающий эндонуклеазной активностью, специфичной в отношении одноцепочечной ДНК; вовлекается в эксцизионный комплекс посредством взаимодействия с TFIIH и RPA.
Механизм NER. Процесс NER условно можно разделить на четыре этапа: а) распознавание поврежденного участка ДНК; б) двойное надрезание (инцизия) цепи ДНК по обеим сторонам поврежденного участка и его удаление (эксцизия); в) заполнение бреши в процессе репаративного синтеза; г) лигирование оставшегося одноцепочечного разрыва ДНК. Феномен NER, как и многие другие генетические явления, имеющие общебиологическое значение, впервые обнаружен у E. coli. Было установлено, что мутантные УФ-чувствительные клетки E. coli не могут удалять из ДНК тиминовые димеры, возникающие в ответ на действие УФ-света. Вскоре стало ясно, что система эксцизионной репарации не является специфичной в отношении только тиминовых димеров, но способна распознавать и удалять любые повреждения ДНК, возникающие в результате ковалентных модификаций составляющих ее мономеров. Для понимания механизмов узнавания системой эксцизионной репарации поврежденных участков ДНК необходимо ответить, по крайней мере, на три важных вопроса: 1) распознает ли система только поврежденные (модифицированные) основания в ДНК; 2) как система осуществляет выбор цепи ДНК для репарации; 3) каковы молекулярные механизмы распознавания поврежденных участков?
Оказалось, что поврежденные (модифицированные) основания – не единственный субстрат для этой ферментной системы. NER человека распознает и удаляет одиночные ошибочно спаренные нуклеотиды, а также петли длиной в 1–3 нуклеотида. Однако в отличие от истинной репаративной системы, удаляющей неправильно спаренные основания, NER не может идентифицировать, нуклеотид какой цепи ДНК оказывается правильным. В результате происходит вырезание неспаренных нуклеотидов из любой цепи случайным образом. В отличие от только что рассмотренной ситуации NER человека способна различать цепи ДНК в случае распознавания поврежденных нуклеотидов. В частности, показано, что при наличии в ДНК димеров тимина циклобутанового типа вырезание нуклеотидов происходит исключительно из поврежденной цепи. Механизм такого распознавания в настоящее время неизвестен. К сожалению, остается непонятным и молекулярный механизм узнавания самих поврежденных оснований. Следует заметить, что система способна распознавать повреждения как сильно, так и слабо деформирующие вторичную структуру ДНК. При этом не обнаружена линейная зависимость между коэффициентом специфичности нуклеазы (kcat/km) и уровнем деформации двойной спирали ДНК. Показано, что в процессе распознавания участвуют белковые комплексы XPA/RPA, которые преимущественно связываются с поврежденной ДНК, и TFIIH, обладающий АTP-зависимой ДНК-расплетающей активностью. Последний взаимодействует с поврежденным участком ДНК и по аналогии с соответствующим механизмом у E. coli локально раскручивает ДНК, создавая основной преинцизионный комплекс с поврежденной ДНК.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Недавно было установлено, что три фермента репарации, обладающие узкой субстратной специфичностью: ДНК-фотолиаза (удаление пиримидиновых димеров), урацилгликозилаза (удаление урацила из ДНК) и экзонуклеаза III (гидролиз ДНК в AP-сайтах), втягивают поврежденный участок из двойной спирали в полость фермента, что приводит кофактор или аминокислотные остатки активного центра этих ферментов в непосредственный контакт с расщепляемыми связями ДНК. Не исключено, что система эксцинуклеазы действует таким же образом.
Основные этапы функционирования NER, следующие за распознаванием поврежденного участка ДНК, представлены на рис. I.59. После того как комплекс XPA–RPA связывается с измененным участком ДНК, XPA взаимодействует с комплексом TFIIH, который создает преинцизионный комплекс, что сопряжено с гидролизом ATP. ATP-зависимое расплетание ДНК комплексом TFIIH подготавливает ее к взаимодействию с двумя XP-белками, обладающими нуклеазной активностью. XPG связывается с TFIIH и вносит одноцепочечный разрыв с 3’-конца повреждения. Аналогично комплекс ERCC1–XPF взаимодействует с XPA в составе преинцизионного комплекса и способствует одноцепочечному разрыву с 5’-конца повреждения. Образование обоих разрывов является ATP-зависимым, и их расположение на ДНК высокоспецифично. Как правило, происходят разрывы 5-й и 24-й фосфодиэфирных связей соответственно от 3’- и 5’-концов поврежденных участков. Однако расположение точек разрывов может варьировать (см. выше). Таким образом, в результате подобных одноцепочечных надрезов ДНК может освобождаться фрагмент длиной 24–32 нуклеотида с преобладанием фрагментов длиной 27–29 нуклеотидов. На расположение сайтов одноцепочечных разрывов оказывают влияние как характер повреждения, так и последовательности нуклеотидов (контекст), окружающих поврежденный участок. Ту же самую картину инцизии обнаруживают in vivo в ооцитах Xenopus и у Schizosaccharomyces pombe. На этом основании делают вывод об универсальном механизме эксцизионной репарации у эукариот.
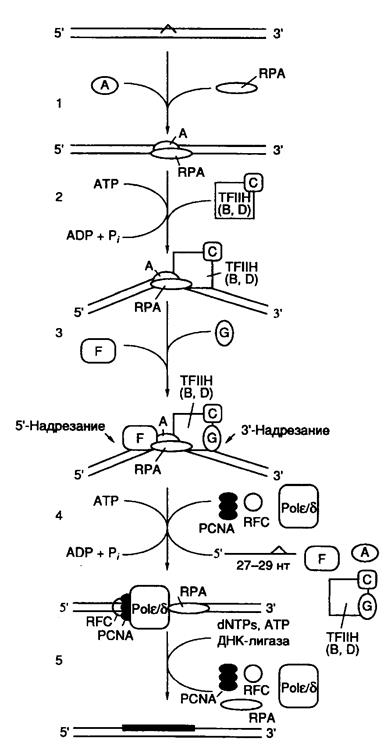
Рис. I.59. Модель эксцизионной репарации (NER) у млекопитающих
Обозначены белок-белковые и белково-нуклеиновые взаимодействия, возникающие при функционировании NER. A–F – продукты генов XPA–XPF
Репаративный синтез ДНК у человека является PCNA-зависимым (см. раздел 4.1.3), т.е. может осуществляться с участием ДНК-полимераз Pold и Pole. PCNA связывается с системой праймер–матрица под действием фактора репликации RFC, откуда следует, что последний также участвует в репаративном синтезе ДНК. В опытах с бесклеточными системами моноклональные антитела к Pold специфически подавляют репаративный синтез. Однако оказалось, что в тех же высокоочищенных бесклеточных системах вместо Pold с аналогичным эффектом могут быть использованы Pole и даже фрагмент Кленова ДНК-полимеразы I E. coli. Это означает, что реконструированные из очищенных компонентов бесклеточные системы лишь в ограниченной степени имитируют биохимические процессы, происходящие в живых клетках. В настоящее время считается, что обе ДНК-полимеразы – Pold и Pole участвуют в репаративном синтезе ДНК у человека.
Сопряжение NER с транскрипцией. Транскрибируемые последовательности нуклеотидов ДНК, особенно в матричной цепи, репарируются с большей скоростью, чем нетранскрибируемые последовательности. Интересно, что в клетках больных с синдромом Кокайна не наблюдается такой асимметрии в репарации.
В клетках E. coli белковый фактор, кодируемый геном mfd и сопрягающий транскрипцию и репарацию, замещает остановившиеся перед повреждением молекулы РНК-полимеразы, что приводит к диссоциации транскрипционного комплекса. При этом он одновременно привлекает экзонуклеазный репаративный комплекс к поврежденному участку ДНК. В клетках животных ген CSB кодирует белок с молекулярной массой 160 кДа, который содержит так называемый хеликазный домен (мотив) и, возможно, выполняет те же функции, что и белок Mfd у E. coli. На основе поведения клеток с мутантными генами белков CSA и CSB разработана простая модель механизма, с помощью которого обеспечивается асимметричная репарация цепей ДНК. В соответствии с этой моделью РНК-полимераза II, остановившаяся в процессе транскрипции перед поврежденным участком ДНК, распознается комплексом CSA–CSB и перемещается в сторону от повреждения без разрушения четвертичной структуры транскрипционного комплекса. Одновременно комплекс CSA–CSB привлекает компоненты репаративной системы XPA и TFIIH к месту повреждения ДНК и помогает сборке эксцинуклеазного комплекса. Нуклеотиды поврежденной цепи вырезаются, и брешь репарируется. После этого РНК-полимераза в составе транскрипционного комплекса продолжает транскрипцию.
Регуляция NER. Для клеток животных не характерен так называемый SOS-ответ, свойственный клеткам E. coli и представляющий собой суммарную реакцию бактериальной клетки на повреждение ДНК различными агентами, что проявляется, в частности, в усилении транскрипции генов NER. Точно так же посттрансляционные модификации белков репарации, происходящие в ответ на повреждение ДНК, не влияют на активность эксцинуклеазы человека. Было обнаружено, что повреждения ДНК стабилизируют белок р53 – белок-супрессор опухолевого роста, который является регулятором транскрипции. Имеются данные о том, что белок р53 может взаимодействовать с белками XPB и RPA, необходимыми для NER. Однако клетки с инактивированными генами р53 (p53(-/-)), как и клетки дикого типа, эффективно удаляют из поврежденной ДНК два основных фотопродукта, возникающих под действием УФ-света, и обладают такой же устойчивостью к УФ. Поэтому в настоящее время считается, что белок р53 не оказывает прямого влияния на NER. Белки Cdk7 и циклин H, которые образуют Cdk-активирующую киназу, входят в состав комплекса TFIIH, что позволяет предполагать наличие связи репарации ДНК с фазами клеточного цикла.
|
|
