
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на направление реакции
|
|
Рассмотрим влияние температуры на направление реакции на примере синтеза аммиака.
3 H2(г) + N2(г) = 2 NH3(г)
Выпишем из Приложений1 и 2 значения стандартных этальпий Δ H0f, кДж/моль и энтропий S0, Дж/(К· моль):
| Соединение | NH3(г) | H2(г) | N2 (г) |
| Δ H0f, кДж/моль | -46, 19 | ||
| S0, Дж/(К·моль) | 192, 5 | 130, 6 | 191, 5 |
Рассчитаем изменение энтальпии и энтропии
Δ H0 = 2 Δ H0f, NH3(г) - (Δ H0f, N2(г) + 3 Δ H0f, H2(г)) = 2·(-46, 19) – (0 +3·0) = -92, 38 кДж;
Δ S0 = 2S0NH3(г) - (S0N2(г) + 3S0H2(г)) = 2·192, 5 – (191, 5 + 3·130, 6) = -193, 3 Дж/К.
Найдем Δ G0 этой реакции для температур: 25 0С и 350 0С.
- 250С, (25 + 273 = 298 К)
Δ G0 = Δ H0 – T · Δ S0 = -92, 38 – 298 · (-198, 3 · 10-3) = -33, 29 кДж; Δ G0< 0
- 3500С, (350 + 273 = 623 К)
Δ G0 = Δ H0 – T · Δ S0 = -92, 38 – 623· (-198, 3 ·10-3) = 31, 16 кДж; Δ G0> 0
Следовательно, при 25 0С принципиально возможно протекание реакции синтеза аммиака, а при сильном нагревании системы аммиак получить нельзя.
Правда, при 250С реакция протекает очень медленно и с малым выходом. Ускорение реакции достигается факторами химической кинетики, которые будут рассмотрены далее.
Направление реакции зависит от характера изменения Δ G в соответствии с уравнением
Δ G = Δ H – T · Δ S
влияние температуры на Δ G определяется знаком и величиной Δ S.
На рис. 4 показана зависимость Δ G для реакций:
а) 2C(графит) + O2(г) = 2CO(г), Δ S > 0;
б) 2Hg(ж) + O2(г) = 2HgO(к), Δ S < 0;
с) C(графит) + O2(г) = CO2(г), Δ S≈ 0.
а) Реакция 2С(графит) + О2(г) = 2СО (г) протекает с увеличением объема, поэтому Δ S > 0. Судя по графику, повыение температуры приводит к увеличению отрицательного значения Δ G, т.е. благоприятно для протекания процесса.
б) Реакция 2Hg(ж) + O2(г) = 2HgO(к) протекает с уменьшением объема системы, изменение энтропии Δ S < 0. При повышении температуры отрицательное значение Δ G уменьшается. Значит, в этом случае высокотемпературный режим препятствует протеканию процесса. При температуре 500 К значение Δ G становится положительным. Выше этой температуры реакция протекает в обратном направлении. Значит, при температуре ниже 500 К происходит образование оксида ртути (II), а выше 500 К он будет распадаться на простые вещества.
с) Для реакции С (графит) + О2 (г) = СО2 (г) энтропия практически не меняется Δ S ≈ 0, так как в левой и правой части уравнения одинаковое число молей газообразных веществ. Следовательно, зависимость Δ G от температуры соответствует прямой, параллельной оси абсцисс (рис.4). Если в ходе реакции энтропия системы не меняется, то значение Δ G от температуры практически не зависит.
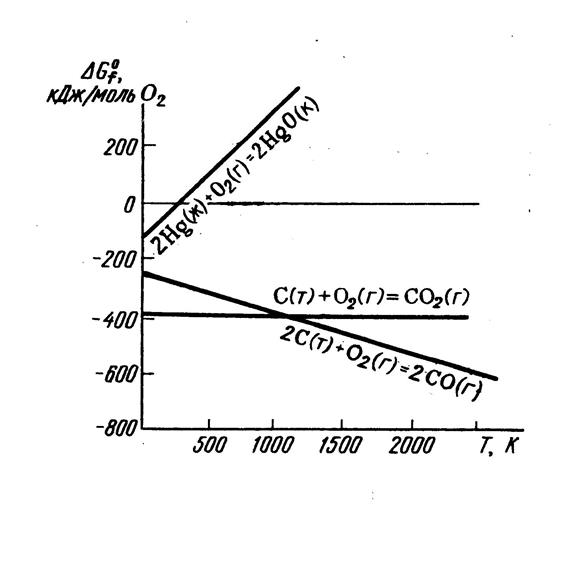
Рис. 4. Зависимость Δ G от температуры для ряда оксидов.
|
|