
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Убиквитин-зависимая система протеолиза в регулируемой деградации белков
|
|
Убиквитин-зависимая система протеолиза проводит поиск потенциальной мишени для протеолитической деградации среди огромного числа внутриклеточных белков. Все белки несут в себе специфические сигналы деградации по аналогии с сигнальными последовательностями, которые направляют вновь синтезируемые белки к определенным органеллам или микрокомпартментам клетки. Однако сигналы протеолитической деградации должны быть более сложными и разнообразными, так как с их помощью не только маркируются белки, удаляемые с помощью протеолиза, но и определяется время удаления, а также скорость их протеолитического расщепления. Для распознавания и декодирования таких сигналов в клетках эукариот имеется убиквитин-конъюгирующая система.
Как в ядре, так и в цитоплазме эта система отделена пространственно и функционально от протеолитических ферментов, организованных в протеасомы. Распознанные данной системой белки-субстраты маркируются путем ковалентного присоединения к ним молекул небольшого стабильного 76-звенного белка – убиквитина. В результате убиквитин соединяется C-концом с боковыми остатками лизина в субстрате. Наличие такой метки в белке, по-видимому, является первичным сигналом сортировки, направляющей образовавшиеся конъюгаты к протеасомам. В большинстве случаев к субстрату присоединяется несколько молекул убиквитина, которые организованы в виде бусинок на нитке. Молекулы белков, содержащие убиквитин, по-видимому, являются для протеасом предпочтительными субстратами. Конъюгацию убиквитина с субстратом можно представить следующим образом (рис. I.41). Вначале убиквитин-активирующий фермент (E1) связывает убиквитин, гидролизует ATP и образует тиоэфирную связь между AMP и убиквитином с последующим переносом молекулы убиквитина на один из своих остатков Cys. Молекула активированного убиквитина далее соединяется с одним из ферментов семейства убиквитин-конъюгирующих ферментов (E2) и часто вслед за этим с убиквитин-лигазой (E3). Процесс конъюгации убиквитина с субстратом может катализироваться как самим E2, так и E2 совместно с E3. Белки E2 и E3 в клетках существуют в виде больших семейств, члены которых различаются по свойствам и внутриклеточной локализации. Мутации в генах семейства E2 у дрожжей показывают, что в ДНК-репарацию, прохождение клеточного цикла, биогенез пероксисом, а также в обеспечение устойчивости к тепловому шоку и ионам кадмия вовлечены разнообразные ферменты. Некоторые из ферментов E2 способны образовывать между собой гетеродимеры, которые, вероятно, в сочетании с различными белками E3 обеспечивают весь большой репертуар субстратных специфичностей убиквитин-конъюгирующих комплексов.
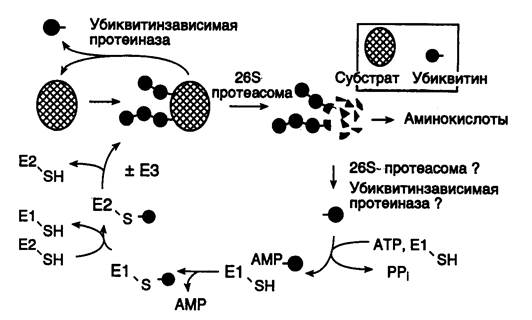
Рис. I.41. Этапы функционирования убиквитинзависимой системы протеолиза
Е1–Е3 – ферменты, активирующие убиквитин с функционально-активными SH-группами, PPi – неорганический пирофосфат
Структура и функционирование протеасомы. Белки, меченные цепями убиквитина, после взаимодействия с протеасомами расщепляются до коротких пептидов и свободных аминокислот в результате ATP-зависимой реакции. У эукариот протеасомы присутствуют в цитозоле и ядрах, но не в других клеточных органеллах. Протеасомы выделяют в виде индивидуальных частиц с коэффициентами седиментации 20S и 26S. 20S частица является коровой частью 26S частицы, которая обладает протеолитической активностью. Коровая частица представляет собой белковый комплекс в виде цилиндра, через центральный канал которого " протягивается" молекула гидролизуемого белка. В настоящее время в качестве модельного объекта часто используют протеасомы архебактерии Thermoplasma, которые были закристаллизованы и исследованы с помощью рентгеноструктурного анализа.
Установлено, что протеасома Thermoplasma построена из двух (a и b) субъединиц. Кольцевые структуры на обоих концах цилиндра протеасомы составлены из a-, а центральная часть – из b-субъединиц в отношении a7b7b7a7 (рис. I.42). Протеолитическая активность присуща b-субъединицам, причем их активные центры направлены внутрь полости цилиндра протеасомы. Кроме того, кольца a-субъединицы по обоим концам молекулы образуют узкие отверстия диаметром ~13 Å, через которые может пройти только развернутая цепь полипептида. Это механистически объясняет, каким образом протеасома избирательно расщепляет полипептидные цепи белков, меченные убиквитином. Прежде чем войти в контакт с активными центрами протеиназ, полипептидная цепь деградируемого белка должна быть развернута. Пептиды и аминокислоты, образующиеся в центральной части цилиндра протеасомы, покидают ее через переднее или заднее отверстия, сформированные a-субъединицами. Протеасомы Thermoplasma лишены специфичности в отношении деградируемых белков, и их функционирование требует наличия в N-концевой части b-полипептидов остатка Thr. Интересно, что остатки Thr эукариотических b-субъединиц являются мишенью для антибиотика лактацистина из Streptomyces, который ковалентно связывается с этими остатками, необратимо инактивируя протеасомы.
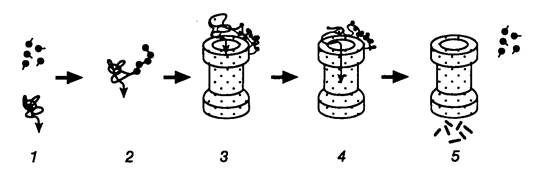
Рис. I.42. Гипотетическая схема функционирования протеасомы убиквитинзависимой системы протеолиза
Молекулы убиквитина присоединяются к деградируемой полипептидной цепи (1, 2) и конъюгат далее взаимодействует с 26S протеасомой (3). Узкий цилиндр изображает кό ровую 20S субчастицу протеасомы, обладающую протеолитической активностью. Полипептидная цепь, разворачиваясь, входит в центральную полость 20S субчастицы, где последовательно подвергается протеолизу (4, 5). При этом цепи убиквитина отделяются от деградируемого белка
Локализация активных центров b-субъединиц внутри протеасомы затрудняет неконтролируемую деградацию окружающих белков. Отдельные субъединицы до включения их в состав зрелых протеасом синтезируются в виде неактивных предшественников, что предотвращает их преждевременное протеолитическое действие и является общим принципом биосинтеза протеолитических ферментов. Подобно тому как ферменты лизосом активируются только после их перемещения в соответствующий компартмент клетки, процессинг b-предшественников сопряжен с их включением в состав протеасом. Сборка протеасом начинается с образования гептамерных a-субчастиц (a7), которые стимулируют аутокаталитическое удаление пропоследовательности предшественника b-субъединиц, что приводит к их упорядоченной самосборке с образованием гептамерных b-субчастиц (b7), состыкованных с a-субчастицами. Две предварительно собранные половины протеасомы (a7b7) далее ассоциируют друг с другом с образованием активных 20S протеасом. Очищенные 20S протеасомы эффективно расщепляют небольшие пептиды, но не способны гидролизовать интактные белки. Распознавание конъюгатов убиквитина и разворачивание белковой глобулы происходят с участием ~16 белков, ассоциированных с 20S протеасомой и образующих 26S комплекс. Эти белки способны объединяться в отдельные комплексы, получившие название 19S-кэп-структур. 19S-комплексы ассоциируют друг с другом в присутствии ATP и с 20S протеасомами in vitro, присоединяясь к концам цилиндра.
Протеасомы обеспечивают не только полную деградацию полипептидов, но и участвуют в процессинге предшественников с образованием зрелых, активных белков. В частности, процессинг субъединицы p50 транскрипционного фактора NF-kB животных, сопровождающийся отщеплением и деградацией С-концевой части полипептида, происходит с помощью 26S протеасом.
Процессинг антигенов. В настоящее время сформировалось мнение о том, что протеасомы клеток животных участвуют в процессинге антигенов, представляемых молекулами первого класса главного комплекса гистосовместимости (MHC). Из семи b-субъединиц протеасом человека лишь три обладают протеолитической активностью. Эндогенный антивирусный агент g-интерферон селективно стимулирует синтез неактивных b-субъединиц, одновременно подавляя образование активных. Две из этих стимулируемых субъединиц, названные LMP2 и LMP7, кодируются генами MHC. До конца не ясно, какой биологический смысл имеет замещение почти всех активных субъединиц на неактивные, однако предполагается, что такое явление может иметь отношение к процессингу антигенов, представляемых для распознавания молекулами MHC. Действительно, для мышей с дефектными LMP2 или LMP7 характерно нарушение презентации некоторых антигенов. По-видимому, пептиды, образующиеся в таких реконструированных протеасомах, по размерам или составу аминокислотных последовательностей соответствуют тому стандарту, который требуется для эффективного действия антигенных детерминант во время иммунного ответа.
|
|
