
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дихальний шлях. Енергетика переносу електронів. Спряженість окисного фосфорилювання з процесом перенесення електронів.
|
|
Ланцюг переносу електронів від NADH та FADH2 на кисень. Перенесенняелектронів від NADH до О2 включає ряд переносників, які локалізовані у внутрішній мембрані мітохондрій. За винятком убіхінону і цитохрому С, це складні білкові комплекси. NADH-дегідрогеназа (NADH-Q-редуктаза, комплекс I) складається з декількох поліпептидних ланцюгів. Роль простетичної групи виконує FMN. Єдиний субстрат ферменту – NADH, з якого 2 електрони і протон переносяться на FMN з утворенням FMNH2. Другий протон поглинається з матриксу. Реакція протікає за рівнянням: NADH + Н+ + Е (FMN) ® NAD+ + E (FMNH2). З FMNH2 електрони переносяться потім на ряд залізо-сірчаних білків (Fe), що виконують роль другої простетичної групи в молекулі NADH-дегідрогенази. Атоми заліза в цих білках (негемове залізо) зібрані в кілька груп, так званих залізо-сірчаних центрів. FeS-центри входять до складу багатьох білків (флавопротеїнів, цитохромів), які беруть участь в окисно-відновних реакціях. Відомі 3 типи FeS-центрів (Fe, Fe2S2, Fe4S4), в яких атом заліза зв'язаний з атомом сірки залишків цистеїну або неорганічної сірки.
NADH-дегідрогеназа містить кілька центрів типу Fe2S2 і Fe4S4. Атоми заліза в таких центрах можуть приймати і віддавати електрони по черзі, переходячи у ферро- (Fe2+) і ферри- (Fe3+) стани. Від залізо-сірчаних центрів електрони переносяться на кофермент Q (убіхінон). Убіхінон виконує колекторну функцію, приєднуючи електрони від NADH-дегідрогенази та інших флавінзалежних дегідрогеназ, зокрема, від сукцинатдегідрогенази. Убіхінон бере участь у реакціях типу: E (FMNH2) + Q ® Е (FMN) + QH2. Цитохроми або гемопротеїни присутні в усіх типах організмів. У клітинах еукаріотів вони локалізовані в мітохондріальних мембранах і в ЕР. Відомо близько 30 різних цитохромів. Усі цитохроми в якості простетичної групи містять гем. У залежності від здатності поглинати світло у визначеній частині спектра всі цитохроми поділяють на групи а, b, с. Усередині кожної групи окремі види з унікальними спектральними властивостями позначають цифровими індексами (b, b1, b2 і т.д.). QH2-дегідрогеназа (коензим Q-цитохром с-редуктаза, комплекс III) складається з 2 типів цитохромів (b1 і b2) і цитохрому с1. QH2-дегідрогеназа переносить електрони від убіхінолу на цитохром с. Усередині комплексу III електрони передаються від цитохромів b на FeS-центри, далі на цитохром с1, а потім на цитохром с. Групи гема, подібно FeS-центрам, переносять тільки по одному електрону. Таким чином, від молекули QH2 2 електрони переносяться на 2 молекули цитохрому b. Як проміжний продукт у цих реакціях переносу електронів можливе утворення вільного радикала семіхінону. У цитохромах типу b гем не зв'язаний ковалентно з білком, а в цитохромах с1 і с він приєднується до білка за допомогою тіоефірних зв'язків. Ці зв'язки утворюються шляхом приєднання 2 цистеїнових залишків до вінільних груп гема.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Організація дихального ланцюга в мітохондріях. Основні переносники електронів вбудовані у внутрішню мембрану мітохондрій і організовані в 4 комплекси, що є розташованими у визначеній послідовності (векторно). У цій послідовності їх стандартні окисно-відновні потенціали стають більш позитивними в міру наближення до кисню. Кожна ланка цього ланцюга специфічна у відношенні донора й акцептора електронів. На першому етапі дегідрогенази каталізують відщіплення водню від різних субстратів. Якщо субстратами служать a-гідроксикислоти малат, ізоцитрат, 3-гідроксібутират, водень переноситься на NAD+. NADH, що утворився, у дихальному ланцюзі, у свою чергу, киснюється NADH-дегідрогеназою (комплекс I). Якщо субстратами служать такі сполуки, як сукцинат або гліцерол-3-фосфат, акцепторами водню є FAD-залежні дегідрогенази. Від NADH і FADH2 електрони і протони передаються на убіхінон і далі через ланцюг цитохромів до молекулярного кисню. Дотепер точно невідомо, яким чином розташовані всі переносники електронів дихального ланцюга. Однак установлено, що в розташуванні дихальних комплексів існує визначена асиметрія: деякі з білків-переносників знаходяться ближче до тієї сторони внутрішньої мембрани, що звернена до матриксу, а інші – до протилежного; деякі білки пронизують мембрану наскрізь.
Інгібітори дихального ланцюга. Вивченню послідовності переносу електронів сприяло дослідження дії специфічних інгібіторів, що блокують визначені етапи цього процесу (рис. 8). Переносники електронів, які знаходяться в ланцюзі безпосередньо перед блокованим етапом, стають більш відновними, а ті що знаходяться після цього етапу – більш окисними. Довести це твердження можна за допомогою спектрофотометра, тому що в окисних і відновних форм переносників різні спектри поглинання.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Механізм спряження окиснення та фосфорилювання. Найбільш обґрунтовану відповідь на це питання дає хеміосмотична теорія Мітчелла, запропонована ним у 1961 р. Основні положення були підтверджені й розроблені детально спільними зусиллями багатьох дослідників у наступні роки. Переносення електронів по дихальному ланцюгу від NADH до кисню супроводжується викачуванням протонів з матриксу мітохондрій через внутрішню мембрану в міжмембранний простір. На цю роботу затрачається частина енергії електронів, які переносяться по ЛПЕ. Протони, що переносяться з матриксу в міжмембранний простір, не можуть повернутися назад у матрикс, тому що внутрішня мембрана непроникна для протонів. Таким чином, створюється протонний градієнт, при якому концентрація протонів у міжмембранному просторі більше, а рН менше ніж у матриксі. Крім того, кожен протон несе позитивний заряд, і внаслідок цього з'являється різниця потенціалів по обидві сторони мембрани: негативний заряд на внутрішній стороні та позитивний – на зовнішній. У сукупності електричний і концентраційний градієнти складають електрохімічний потенціал DmН+ – джерело енергії для синтезу АТФ. Найбільш активний транспорт протонів у міжмембранному просторі, який є необхідним для утворення DmН+, відбувається на ділянках ЛПЕ, що відповідають розміщенню комплексів I, III і IV. Ці ділянки називають пунктами спряження дихання та фосфорилювання (рис.А). Механізм транспорту протонів через мембрану мітохондрій в пунктах спряження недостатньо ясний. Однак встановлено, що важливу роль у цьому процесі відіграє КоQ. Більше детально механізм переносу протонів за участі KoQ вивчений на рівні комплексу III (рис. Б).
KoQ переносить електрони від комплексу I до комплексу III і протони з матриксу в міжмембранний простір, тобто відбуваються своєрідні циклічні перетворення, названі Q-циклами. Донором електронів для комплексу III є відновлений убіхінон (QH2), а акцептором – цитохром с. Цитохром с знаходиться зі зовнішньої сторони внутрішньої мембрани мітохондрій; там же розташовується активний центр цитохрому с1, з якого електрони переносяться на цитохром с.
У мембрані існує стаціонарний загальний фонд Q/QH2, з якого кожна молекула QH2 в одному циклі забезпечує перенесення протонів із матриксу в міжмембранний простір і електронів, що в остаточному підсумку надходять на кисень. На роботу, спричинену при викачуванні протонів, витрачається частина вільної енергії, що звільняється при перенесенні електронів по градієнту редокс-потенціала. Енергія електрохімічного потенціалу (DmН+) використовується для синтезу АТФ, якщо протони повертаються в матрикс через іонні канали АТФ-синтази.
| Рис. А. Спряження дихання та синтезу АТФ у мітохондріях: І – НАДН-дегідрогеназа; ІІ – сукцинат дегідрогеназа; ІІІ – QН2-дегідрогеназа; ІV – цитохрооксидаза; V – АТФ-синтаза. Енергія протонного потенціалу (електрохімічного потенціалу DmН+) використовується для синтезу АТФ, якщо протони повертаються до матриксу крізь іонні канали АТФ-синтази. | 
|
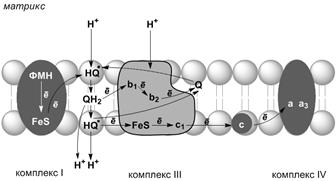
| Рис. Б. Сполучення перенесення електронів крізь дихальний комплекс ІІІ із транспортом Н+ крізь мембрану Відновлений убіхінон (QН2) взаємодіє з Fе3+ гему b1, і відновлюючи його, вивільняє протон водну фазу, та перетворюється в семихінон (НQ·). Електрон від гему b1 переноситься на Fе3+ гему b2. НQ· віддає другий електрон на FеS-центр, який знаходиться ближче до зовнішньої поверхні мембрани; при цьому другий протон опиняється в міжмембранному просторі; електрон надходить до цитохрому с1, а далі до цитохрому с. Окиснений Q дифундує до внутрішньої поверхня мембрани, де отримує електрон від гему b2 і протон із матриксу, перетворюючись у НQ·. НQ· отримує електрон від комплексу І та протон із матриксу; у мембрані утворюється QН2, і весь процес повторюється з початку. |
|
|
