
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рівняння Міхаеліса-Ментен. Константа Міхаеліса та макс. швидкість ферм. реакції. Конкурентне та неконкурентне інгібування.
|
|
Для ферментативних реакцій характерне явище насичення ферменту субстратом. Полягає вона в тому, що при збільшенні концентрації S швидкість спочатку збільшується, досягає максимального значення при деякій концентрації субстрату а і залишається постійною. Відбувається це тому, що при концентрації а весь фермент пов'язаний в фермент-субстратної комплекс.
Залежність швидкості ферментативної реакції від концентрації субстрату може бути описана рівнянням:
υ = υ max / (1 + Kм / [S]), Км = k2 + k-1/k1
де: Км - константа Міхаеліса, яка відповідає концентрації субстрату, при якій v реакції дорівнює 1 / 2 υ max.
Конкурентне інгібування викликають речовини, що мають структурний подібність із субстратом. А саме інгібітор в результаті структурної відповідності із субстратом реагує з активним центром ферменту, утворюючи фермент-інгібіторний комплекс (EI). Це інгібування оборотне. Неактивний EI-комплекс здатний до дисоціації. Субстрат і інгібітор конкурують за зв'язування активного центру ферменту. При високій концентрації субстрату він відтісняє інгібітор і ступінь гальмування реакції зменшується.
На конкурентному інгібуванні пов'язано лікування бактеріальних інфекцій з допомогою сульфаніламідних препаратів. Вони мають структурну схожість з р-амінобензойною кислотою, яка використовується бактеріями для синтезу фолевой кислоти - фактора їх зростання. Точніше гальмування синтезу фолевой кислоти в присутності сульфаніламідів обумовлює бактеріостатичний ефект останніх.
Неконкурентне інгібування викликають речовини не мають структурної схожості з субстратом. Вони можуть приєднуватися до різних частин молекули ферменту, викликаючи блокування окремих функціональних груп або іонів металу в молекулі ферменту, перешкоджаючи утворенню ES-комплексу.
Різновидом неконкурентного інгібування - аллостеричне інгібування. У цьому випадку інгібітор з'єднується з аллостеричним центром ферменту, змінюючи структуру його активного центру. Аллостеричне інгібування оборотне.
Аналіз рівняння Міхаеліса-Ментен:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Якщо концентрація субстрату в реакції низька, тобто [S] < < Кm, то рівняння набуває вигляду:
Таким чином, при низьких концентраціях субстрата швидкість біохімічної реакції прямо пропорційна концентрації субстрату і описується рівнянням I порядку.
При високих концентраціях субстрату, тобто [S]> > Кm, величиною Кm можна знехтувати.
Таким чином, при високих концентраціях субстрта швидкість біохімічної реакції стає максимально і описується рівнянням нульового порядку.
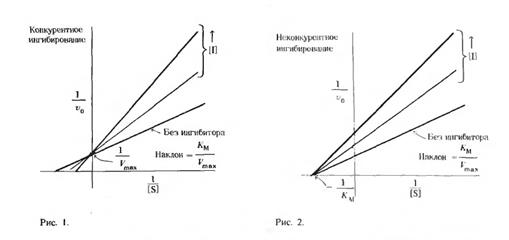 Графік конкурентного і не конкурентного інгібування:
Графік конкурентного і не конкурентного інгібування:
|
|
