
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Буферные системы
|
|
буферные системы образованы буферными растворами
буферные – растворы, рН которых почти не меняется
при разбавлении или добавлении небольших количеств к-ты или основания
ПР: ацетатный СН3СООН + СН3СООNa
гидрокарбонатный Н2СО3 + NaНСО3
аммиачный NН4ОН + NH4Cl
фосфатный NaH2PO4 + Na2HPO4
бикарбонатный NaНСО3 + Na2СО3
согласно протонной теории буферные системы - сопряженные кислотно-основные пары B/BH+ и НА/А-
B + H+ Û BH+ HA Û H+ + A-
основание сопряженная к-та к-та сопряженное основание
в живых организмах буферные системы поддерживают кислотно-основный гомеостаз
кислотно-основный гомеостаз - кислотно-основное равновесие внутренней среды организма
рН внутренней среды организма должен быть оптимальным для биохимических реакций
для человека физиологическое значение pH=7, 4
кислотно-основное равновесие поддерживают буферные свойства крови и механизмы коррекции
62) Классификация буферных систем.
буферные системы различают по компонентам:
- слабая кислота и ее соль, образованная сильным основанием – буферная система кислотного типа
ПР: ацетатный буфер СН3СООН + СН3СООNa
гидрокарбонатный буфер Н2СО3 + NaНСО3
по теории Берстреда буферная система кислотного типа - сопряженная кислотно-основная пара НА/А-
ПР: ацетатный буфер СН3СООН/СН3СОО-
гидрокарбонатный буфер Н2СО3/НСО3-
- слабое основание и его соль, образованная сильной кислотой – буферная система основного типа
ПР: аммиачный буфер NН4ОН + NH4Cl
по теории Берстреда буферная система основного типа - сопряженная кислотно-основная пара B/BH+
ПР: аммиачный буфер NН4ОН/NH4+
- соли слабых многоосновных кислот – буферная система кислотного типа
ПР: фосфатный буфер NaH2PO4 + Na2HPO4
бикарбонатный буфер NaНСО3 + Na2СО3
по теории Берстреда буферная система кислотного типа - сопряженная кислотно-основная пара НА/А-
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
ПР: фосфатный буфер H2PO-/HPO42-
бикарбонатный буфер НСО3-/СО32-
- амфолиты – буферная система кислотного типа
ПР: аминокислотный буфер
белковый буфер
63)М еханизм действия ацетатного буфера.
ацетатный буфер состоит из уксусной кислоты СН3СООН и ацетата натрия СН3СООNa
- уксусная кислота – слабый электролит
СН3СООН Û СН3СОО- + Н+
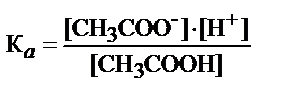


где К а =1, 85× 10-5 - коэффициент диссоциации уксусной кислоты
- ацетат натрия – сильный электролит
СН3СООNa® СН3СОО- + Na+
ацетат натрия увеличивает концентрацию аниона СН3СОО-
равновесие реакции СН3СООН Û СН3СОО- + Н+ смещается влево
диссоциация уксусной кислоты тормозится
практически, анион СН3СОО- образуется только путем диссоциации ацетата натрия СН3СООNa
молярная концентрация аниона СН3СОО- равна молярной концентрации соли [СН3СОО-]=[СН3СООNa]
 - рН ацетатного буфера определяет К а =1, 85× 10-5 и соотношение концентрации уксусной кислоты и ацетата натрия
- рН ацетатного буфера определяет К а =1, 85× 10-5 и соотношение концентрации уксусной кислоты и ацетата натрия
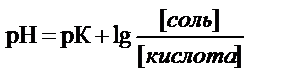
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности уксусной кислоты
- при разбавлении ацетатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН ацетатного буфера сохранится
- при добавлении кислоты идет реакция кислоты и ацетата натрия
СН3СОО- + Na+ + H+ + Cl-® СН3СООH + Na+ + Cl-
катионы водорода H+ связываются анионами уксусной кислоты СН3СОО- + H+ ® СН3СООH
рН ацетатного буфера изменится за счет увеличения концентрации уксусной кислоты и уменьшения соли
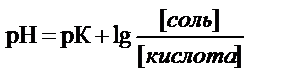
механизм изменения рН:
*хотя образуется избыток уксусной кислоты СН3СООH и равновесие реакции СН3СООН Û СН3СОО- + Н+ смещается вправо,
но по закону Освальда повышение концентрации СН3СООH снижает степень ее диссоциации,
и концентрация катионов водорода H+ увеличивается незначительно,
поэтому при добавлении кислоты рН ацетатного буфера, практически, не изменится
- при добавлении основания идет реакция основания и уксусной кислоты
СН3СООH + Na+ + ОН-® СН3СОО- + Na+ + Н2О
гидроксид-ионы ОH- связываются катионами водорода уксусной кислоты ОН- + H+ ® Н2О
рН ацетатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
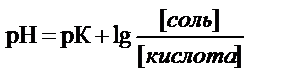
механизм изменения рН:
*хотя образуется избыток аниона уксусной кислоты СН3СОО- и
равновесие реакции СН3СООН Û СН3СОО- + Н+ смещается влево,
но по закону Освальда снижение концентрации СН3СООH повышает степень ее диссоциации,
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
и концентрация катионов водорода H+ уменьшается незначительно,
*хотя уксусная кислота расходуется,
но диссоциируют на катионы водорода H+ только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН ацетатного буфера, практически, не изменится
- при добавлении небольших количеств кислот-щелочей изменение рН ацетатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН ацетатного буфера значительно
|
|
