
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Недеструктивные последствия взаимодействия клеток со специфическими антителами.
|
|
По современным представлениям, действие противоклеточных антител и аутоантител не обязательно ведет к альтерации клетки-мишени и окружающих тканей. Антитела, направленные против клеточных рецепторов, согласно закономерностям рецепторного эндоцитоза, будут подвергаться быстрой интернализации и ускользать от взаимодействия с гуморальными и клеточными агентами альтерации, действие которых активируют иммуноглобулины, остающиеся на клеточной поверхности (Г.Бендиксен 1976, Р.Вольпе, 1981; Л. Харрисон, 1982; М. Блечер 1984; А.Ш. Зайчик и соавт. 1988). Кроме того, при гиперэргических реакциях 2 типа не редкость - иммуноглобулины, направленные против внутриклеточных и внутриядерных, а не только против поверхностных и экстрацеллюлярных антигенов. Как показано в работах А.Ш.Зайчика и соавторов (1973-1991), Д.Аларкона-Сеговии и др. (1973-1983), Г.Седлачека и соавторов (1983); М.Цунеоки и соавт.(1986) - такие антитела быстро проникают внутрь живых клеток и их ядер. В подобных случаях взаимодействие клетки с антителом имеет результатом различные изменения клеточной пролиферации и генетически детерминированных функций клетки-мишени без ее деструкции, а антитело выступает как гормоноподобный регулятор (в нормальных условиях) или дисрегулятор (при избыточном действии данных механизмов). Антитела к рецепторам могут ингибировать связывание природного лиганда с рецептором, нарушать ионный транспорт через рецептор, ускорять деградацию рецепторов - во всех этих случаях их действие на рост или на функцию клеток будет блокирующим. Весьма частым последствием действия антирецепторных антител на клетку является замещение иммуноглобулином функций лиганда (частичное либо полное, длительное либо кратковременное). Клинически при этом наблюдается гиперфункция и/или гиперплазия клеток-мишеней. Антитела могут, например, вызвать гиперпродукцию гормона или секрета, ускорение деления клеток или индукцию гипертрофических изменений в клетках, не вступающих в митоз. Получены антирецепторные или антиядерные иммуноглобулины, имитирующие полностью или частично эффекты пролактина (Ж.Джанне и соавт., 1981; Р. Шиу, Х.Фриеску, 1976), эпидермального фактора роста (Д.Господарович, 1983), инсулина и вазопрессина (Т.Рейлли, Р.Рут, 1986; И.Кохен, Й.Шехтер, 1988), АКТГ, ТТГ и либеринов гипоталамуса (А.Ш.Зайчик и соавт., 1969-1988, Х.Людденс и соавт, 1982), инсулиноподобного фактора роста (Дж. Хэри и соавт., 1987). Поскольку иммунологический блок или стимуляция антителами клеточных рецепторов целиком приходится на аутоиммунные взаимодействия, подобные состояния будут обсуждаться также в главе об аутоиммунитете. В данном разделе мы ограничимся лишь одной, практически важной иллюстрацией из области астмологии.
П.Куро и соавт. (1983) установили, что одним из механизмов бронхиальной астмы и аллергического ринита, независимым от анафилаксии, может быть так называемый пато-рецепторный механизм. При этом образуются блокирующие действие b2-адренэргических сигналов аутоантитела к соответствующему бронхиальному рецептору. Возможно как спонтанное возникновение этих аутоантител (в таком случае астматическому бронхиту предшествует аллергический ринит без гиперпродукции IgE), так и индукция подобных аутоантител лечением: при частом и обильном использовании b-адренэргических бронхолитиков в качестве монотерапии для купирования приступов при классических формах бронхиальной астмы. Антирецепторные антитела формируются, как аутоантиидиотипические иммуноглобулины против антител к лекарству.
Установлена важная роль подобных антирецепторных антител в патогенезе наиболее опасного осложнения леченной бронхиальной астмы - астматических статусов, обусловленных резистентностью больных к бронхолитикам. Интересно, что А. и И. Сент-Иваньи, еще в 1980-1985 году высказали неклассическую гипотезу о природе анафилаксии, основанную на идее, что это явление представляет собой системную недостаточность функций b2-адренорецепторов, а иммунологические феномены при нём имеют вторичный характер.
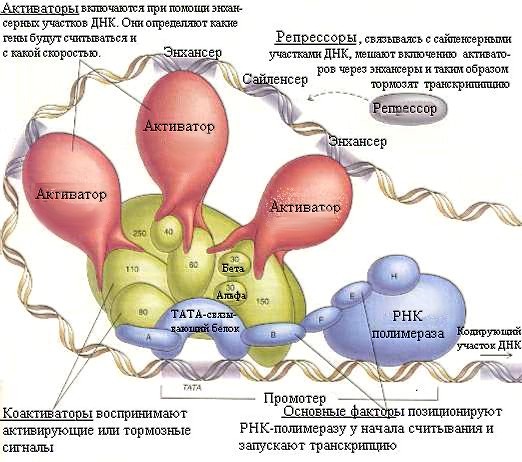
Антиидиотипические аутоантитела могут даже замещать функцию антигенов-ферментов, например, цитохромов (И.Н.Алексеева и соавт., 1987). По нашему мнению, термин " цитотоксические" неприложим к подобным недеструктивным реакциям, хотя их механизмы и имеют много общего с гиперэргическими реакциями 2-го типа. Нами предлагается для обозначения этих процессов в норме термин “циторегулирующие реакции”, а для их патологических проявлений - обозначение “дисрегуляторные реакции”. Возможно также употребление для всей совокупности реакций, опосредованных противоклеточными иммуноглобулинами, термина: “цитокинетические реакции”.
Таблица 7
Классификация цитокинетических реакций.
| Литические | Цитотоксические реакцкии | Цитостимулирующие реакции | ||
| Статические | Тормозные | Активирующие | Регенеративные | |
| Резус- конфликт. | Атрофия коры надпочечников | Астматический статус | Болезнь фон Базедова (антитела против ганглиозидной части рецептора ТТГ) | Микронодуляр-ная гиперплазия коры надпочечников |
| Инсулинзависи-мый сахарный диабет | Препубертатная задержка роста | Гипотиреоз | Стимулирующие антитела к ДНК-протеиду клеток корко-вого веще-ства надпо-чечни-ков (в эксперименте) | Гипертрофичес-кая кардиомиопатия |
| Гломеруло-нефрит | Атрофический гастрит | Миастения гравис | Ауто-иммунная гипогликемия (инсулиномиме-тические аутоантитела) | Спорадический зоб (антитела против белковой части рецептора ТТГ) |
Литические реакции - это цитотоксические реакции, заканчивающиеся разрушением клеток-мишеней. Так, аутоантитела к митохондриям запускают литический механизм, оканчивающийся гибелью печеночных клеток при первичном билиарном циррозе. Аутоантитела к цитоскелету и ядерным антигенам гепатоцитов провоцируют их некроз при хроническом активном гепатите. Статические реакции - это результат блокады рецепторов ростовых факторов тех или иных клеток, в результате чего останавливается пролиферация клеток-мишеней, без их прямого разрушения. Тормозные реакции представляют конкурентное ингибирование антителами эффекта того или иного биорегулятора за счёт связывания поверхностных и внутриклеточных антигенов, ответственных за запуск какого-либо метаболического процесса (транспорт, синтез, распад). Последствия заключаются в торможении того процесса, который антитела мешают дерепрессировать. Рецептор, в комплексе с антителами, может уходить с поверхности клетки и разрушаться в лизосомах, как это, вероятно, и происходит с Н-холинергическим рецептором при тяжелой миастении.
 ......
...... 
Цитостимулирующие антитела - направленные против ядерных, цитоплазматических или поверхностных антигенов конкурентные синэргисты биорегуляторов, дерепрессирующие процессы митоза, синтеза ДНК, транскрипции и другие метаболические реакции. Если они стимулируют рост и деление клетки - применим термин “регенеративные реакции”, а если речь идёт о биосинтетических процессах (например, стероидогенезе) - “активирующие реакции”.
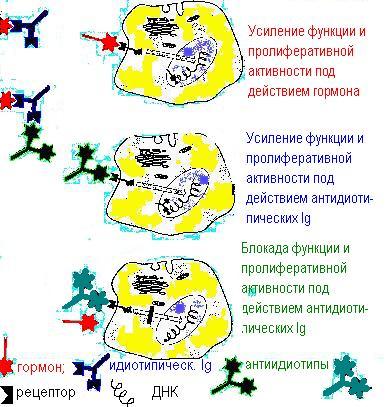
Подобные иммуноглобулины могут образовываться, как антиидиотипы против антител к биорегуляторам и служить пространственной репликой последних. Действие моноспецифических цитостимулирующих антител, по-видимому, в любых дозах не ведёт к цитолизу.

|

|
|

|

|
Иммунокомплексные реакции (Реакции III типа)
Аллергические реакции III типа опосредованы иммунными комплексами.
Иммунные комплексы образуются у всех индивидов при каждом иммунном ответе. Но лишь некоторые иммунные ответы и только у лиц, обладающих предрасположенностью к иммунокомплексным реакциям приводят к аллергическим заболеваниям III типа. Решающими являются особенности судьбы иммунных комплексов в организме.
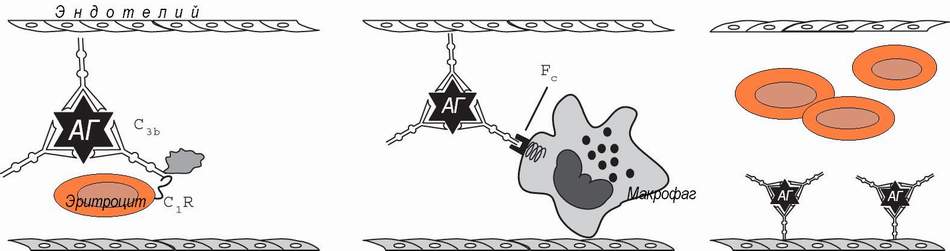
Иммунокомплексные реакции развиваются, если нарушен или относительно недостаточен нормальный клиренс иммунных комплексов и последние, вместо инактивации, фиксируются на сосудистой стенке или в тканях, активируя эффекторные механизмы воспаления, тромбоза и фибринообразования (А.Я..Кульберг; 1985, 1986). Формированию иммунокомплексных реакций благоприятствуют хронические инфекции с персистированием в организме чужеродных антигенов (например, малярия и легочные микозы) и хронические аутоиммунные заболевания (например, системная красная волчанка - СКВ).
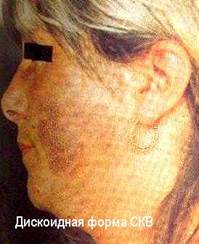
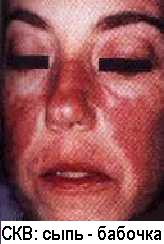 По современным представлениям, иммунокомплексным реакциям способствуют наследственные и приобретенные дефекты в системе клиренса иммунных комплексов.
По современным представлениям, иммунокомплексным реакциям способствуют наследственные и приобретенные дефекты в системе клиренса иммунных комплексов.
У приматов в этой системе ключевую роль играют эритроциты, комплемент и макрофаги.
В норме иммунные комплексы фиксируются эритроцитами, через С3в фрагмент комплемента и CR1 рецептор эритроцитов, что предохраняет их от контакта с сосудистой стенкой, так как основная часть красных кровяных клеток следует в осевом кровотоке.
В синусоидах селезенки и печени, при турбулентном кровотоке, нагруженные иммунными комплексами эритроциты захватываются макрофагами, при участии Fc-рецепторов. Некоторая часть свободных иммунных комплексов, отщепленных от носителей в результате действия фактора I комплемента, захватывается макрофагами непосредственно (Ф.Хэй, 1994).
По данным А.Я.Кульберга (1986), если иммуноглобулины принадлежат к классу IgA, они активируют комплемент альтернативным путём, что приводит к появлению в составе иммунных комплексов C3b - фрагментов комплемента. При классическом пути активации, если в состав комплекса входят IgG, они связывают C1q - фрагменты комплемента. C1q - фрагменты фиксируются нековалентно, а значит - обратимо, к Сg2-домену Fc-фрагмента IgG между аминокислотными остатками N 282 и N 292. После связывания антигена угловое расстояние в молекуле IgG между Fab-фрагментами возрастает. Fc-фрагмент выходит из плоскости, в которой расположены Fab-фрагменты. Это облегчает связывание C1q.
C1q по размеру в 2, 5 раза больше IgG, поэтому его связывание приводит к экранированию части Fc-фрагмента, в связи с чем присоединение комплемент-активирующими антителами С1q мешает их захвату макрофагами (“интерференция эффекторных функций иммуноглобулинов” - по Кульбергу). В ходе дальнейшей активации комплемента, С3b-фрагмент, присоединяясь к комплексу ковалентно, в области Fd -участка Fab-фрагментов, вызывает стерические изменения комплекса, благоприятствующие отщеплению С1q и элиминации комплекса макрофагом. По Х.Такахаши (1980), присоединение С3b повышает растворимость иммунных комплексов, что может быть результатом отщепления C3b и С4b
В соответствии с этим, в норме в IgG-cодержащих комплексах присутствуют C3b и С4b и отстуствует С1q. Иммунные комплексы с IgM cодержат как C3b и С4b, так и С1q.
Из сказанного ясно, что приобретенные и наследственные дефекты и нехватка С3 и других фрагментов комплемента, Fc-рецептора макрофагов, СR1 - рецептора эритроцитов и самого Fc-фрагмента антител (включая его углеводный компонент) будут предрасполагать их носителей к иммунокомплексным болезням.
Это подтверждается наблюдениями о наличии повышенной частоты иммунокомплексных процессов у лиц с наследственным дефицитом С3 и с гипокомплементемией в результате эндотоксинового шока, ожоговой болезни и других процессов с избыточной активацией комплемента по альтернативному пути. Обнаружены генетические дефекты Fc-peцепторов и Fc-фрагментов у больных СКВ и их ближайших родственников (Т.Фрэнк и соавт. 1983). Описаны аутоантитела к конвертазе альтернативного пути комплемента - C3bBb-фрагменту, вызывающие дефицит C3b и мембранозно-пролиферативный иммунокомплексный гломерулонефрит II типа - “болезнь плотных отложений” (С.Р.Нусинов и соавт., 1985). Эти аутоантитела даже называют “нефритогенным фактором”.
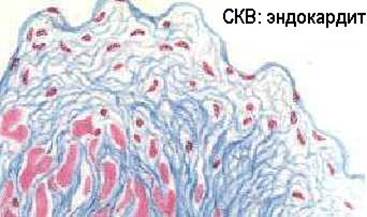 ...
... 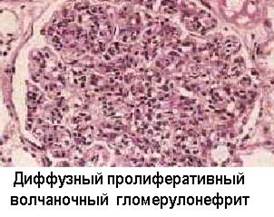 ...
...  ...
...
При подобных условиях время циркуляции иммунных комплексов в крови сокращено, так как они активно оседают на эндотелии и в тканях.
Итак, неустранение иммунных комплексов может отражать превышение скорости их продукции над доступными индивиду темпами их клиренса. Это происходит:
· из-за нарушения экспрессии или функционального дефекта рецепторов комплемента и/или Fc-рецепторов на клетках крови, адсорбирующих или фагоцитирующих иммунные комплексы
· из-за нарушения механизмов активации C3b-фрагмента комплемента, его дефицита или инактивации. Этот механизм особенно актуален при процессах, сопровождаемых истощающей активацией альтернативного пути комплемента. Так, при ожоговой болезни эндотоксиновом шоке, аллергоидных реакциях - возможен дефицит из-за его потребления. Распространены и наследственные дефициты факторов комплемента, участвующих в опсонизации иммунных комплексов (см. выше раздел “Медиаторы воспаления”).
· из-за образования комплексов, содержащих антиизотипические аутоантитела (ревматоидных факторов), из-за формирования антиидиотипических аутоантител, а также аутоантител к факторам комплемента (иммуноконглюттининов) или в присутствии кокковых белков, связывающих aнтитела через Fc-фрагменты (стафилококковый протеин А, cтрептококковый протеин М). В последнем случае играет роль гомология этих белков и Fc-фрагментов и антиидиотипическое копирование (П.Кристенсен, А.Шрёдер, 1990)
В этой связи необходимо подчеркнуть важность правильной трактовки результатов определения концентрации циркулирующих иммунных комплексов (ЦИК) в крови. Вопреки распространённой упрощённой интерпретации, высокий уровень ЦИК совсем не означает высокого риска иммунокомплексного заболевания. Гораздо важнее, что при интенсивном развитии иммунокомплексной аллергии этот уровень снижается в динамике, так как комплексы откладываются на сосудистых стенках. Определение иммунных комплексов в сыворотке по их взаимодействию с несущими Fc-рецептор клетками Раджи - это не единственный метод лабораторной диагностики иммунокомплексных реакций. С этой целью применяют также иммуноморфологический анализ (светомикроскопическую визуализацию комплексов и компонентов комплемента в тканях с помощью иммунофлюоресценции по Кумбсу, а также электронномикроскопическое обнаружение депозитов иммунных комплексов). Косвенную роль играет и определение сывороточного уровня и степени утилизации факторов комплемента, как мера его активации (Р.Паттерсон, 1972).
Немалое значение для определения потенциальной патогенности иммунного комплекса имеют и его размеры, и другие физико-химические свойства.
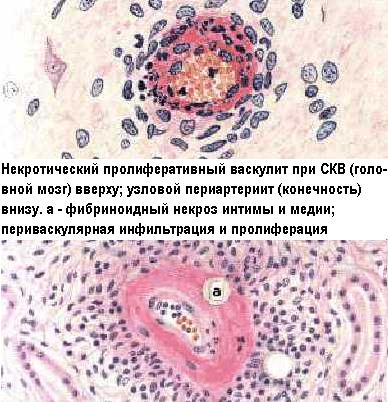 Хотя, принципиально все классы антител способны к образованию иммунных комплексов, наиболее часто поражения содержат депозиты IgG, IgM и IgA. Так как последние не связывают комплемент классическим путём и не фиксируются к эритроцитам, они часто обусловливают значительные депозиты в легких, мозге и почках. Депозиты с участием иммуноглобулинов А ответственны за развитие ряда тяжёлых гломерулопатий. При болезни Бергера депозиты, содержащие IgA, откладываются в мезангии клубочков и вызывают пролиферацию его клеток и гломерулосклероз. Сходные процессы отмечаются при пурпуре Шёнляйн-Геноха. Отложения IgA находят в клубочках и при подостром злокачественном гломерулонефрите с полулуниями, и при очаговом гломерулонефрите. Во всех случаях это сопровождается клиническими проявлениями нефротического синдрома. Интересно, что в IgA-зависимые иммунокомплексные гломерулопатии могут обостряться на фоне острых респираторных вирусных инфекций, вероятно, за счёт гиперпродукции IgA. IgE могут активировать комплемент лишь в очень больших дозах и по альтернативному пути, однако, если в состав иммунных комплексов входят IgE, то облегчается их прочная фиксация на базофилах и мастоцитах, с последующей дегрануляцией этих клеток.
Хотя, принципиально все классы антител способны к образованию иммунных комплексов, наиболее часто поражения содержат депозиты IgG, IgM и IgA. Так как последние не связывают комплемент классическим путём и не фиксируются к эритроцитам, они часто обусловливают значительные депозиты в легких, мозге и почках. Депозиты с участием иммуноглобулинов А ответственны за развитие ряда тяжёлых гломерулопатий. При болезни Бергера депозиты, содержащие IgA, откладываются в мезангии клубочков и вызывают пролиферацию его клеток и гломерулосклероз. Сходные процессы отмечаются при пурпуре Шёнляйн-Геноха. Отложения IgA находят в клубочках и при подостром злокачественном гломерулонефрите с полулуниями, и при очаговом гломерулонефрите. Во всех случаях это сопровождается клиническими проявлениями нефротического синдрома. Интересно, что в IgA-зависимые иммунокомплексные гломерулопатии могут обостряться на фоне острых респираторных вирусных инфекций, вероятно, за счёт гиперпродукции IgA. IgE могут активировать комплемент лишь в очень больших дозах и по альтернативному пути, однако, если в состав иммунных комплексов входят IgE, то облегчается их прочная фиксация на базофилах и мастоцитах, с последующей дегрануляцией этих клеток.
В тоже время, в отличие от анафилактических реакций, для иммунокомплексных реакций необходима значительно более высокая концентрация антител, способность которых специфически связываться с тканями не имеет решающего значения.
В общем, комплексы крупного размера легче и быстрее устраняются из циркуляции эритроцит-макрофагальным механизмом, хотя до исследования этого вопроса иммунологи, с позиций “здравого смысла”, ожидали обратного.
Такие иммунные комплексы, образовавшиеся в зоне эквивалентности, или при избытке антител, не вызывают патологических симптомов, напротив, иммунные комплексы, образовавшиеся при незначительном (но не сильном) избытке антигена, имеют малые и средние размеры, растворимы и могут обладать выраженным цитотоксическим действием. Ф.Хэй (1994) считает, что к отложению иммунных комплексов ведут, прежде всего, иммунные ответы с продукцией аномальных низкоаффинных антител. Именно такие иммуноглобулины возникают при многих аутоиммунных болезнях. Есть свидетельства облегченного образования иммунных комплексов при избытке синтеза антиидиотипических аутоантител у лиц с недостаточной идиотипспецифической супрессией.
Патологические симптомы, вызываемые цитотоксическими иммунными комплексами, обусловлены повреждающим действием клеток и медиаторов воспаления. Активация комплемента в местах отложения иммунных комплексов приводит к повышению проницаемости кровеносных сосудов.
При иммунокомплексных реакциях активация комплемента иммунными комплексами ведет к продукции анафилотоксинов С5а и С3а, а привлеченные хемоаттрактивным действием иммунных комплексов макрофаги выделяют фактор некроза опухолей - ФНО, который настолько важен в механизмах реакций 3 типа, что антитела к нему значительно ослабляют их проявления. Считается, что он опосредует аттракцию нейтрофилов, а привлечение полиморфноядерных лейкоцитов еще более способствует развитию воспаления: не в состоянии фагоцитировать фиксированные в тканях комплексы, нейтрофилы дают экзоцитоз и выделяются протеолитические ферменты (катепсины, коллагеназа, эластаза), что вызывает дальнейшее разрушение собственных тканей.
Важную самостоятельную роль при иммунокомплексных реакциях играют тромбоциты, активируемые иммунными комплексами и запускающие такие неотъемлемые элементы гиперчувствительности 3-го типа, как тромбоз, фибринообразование и, через тромбоцитарные факторы роста, процессы клеточной пролиферации, фиброплазии и ангиогенеза, которые часто наблюдаются в исходе иммунокомплексных поражений, в частности, гломерулопатий.
Список заболеваний, в патогенезе которых участвует иммунокомплексный механизм аллергии очень обширен.
Растворимые иммунные комплексы могут возникать либо в кровотоке (антиген и антитела одновременно находятся в плазме крови) - в этом случае возникает обусловленный иммунными комплексами васкулит; либо в ткани, когда антиген введен туда, а антитела находятся в кровотоке. Происходит их встречная взаимная диффузия и соединение. В этом случае возникает реакция типа феномена Артюса. При отдельных болезнях наблюдаются оба варианта иммунокомплексной аллергии по отдельности, вместе и в комбинации с другими, например, цитотоксическими или ГЗТ-механизмами.

|

|
|

|

|
|
|