
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей. Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и
|
|
Гидролиз солей – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды.
Соли – это сложные вещества, диссоциирующее на катионы металла и аниона кислотного остатка. Соли могут быть образованы:
- сильным основанием и сильной кислотой,
- сильным основанием и слабой кислотой,
- слабым основанием и сильной кислотой,
- слабым основанием и слабой кислотой.
Гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электр олита. Соли, образованные сильными основаниями и сильными кислотами гидролизу не подвергаются. Таким образом, возможность протекания гидролиза соли определяется наличием иона от слабого электролита.
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительно и преимущественно по первой ступени (один моль ион слабого электролита взаимодействует только с одним моль молекул воды).
Реакцию среды, имеющую место в результате протекания процесса гидролиза, можно прогнозировать по иону от сильного электролита, входящего в состав соли. Если соль образована анионом слабой кислоты ( S2–, 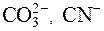 и др.) и катионом сильного основания, то происходит гидролиз по аниону, а среда будет щелочной.
и др.) и катионом сильного основания, то происходит гидролиз по аниону, а среда будет щелочной.
Например, карбонат натрия Na2CO3 в растворе подвергается гидролизу по аниону, так как соль образована слабой угольной кислотой (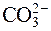 – анион от слабого электролита).
– анион от слабого электролита).
Процесс гидролиза в этом случае сопровождается образованием малодиссоциирующего гидрокарбонат – иона. Так как в растворе появляется избыток гидроксид – ионов, то раствор будет иметь щелочную реакцию среды (рН > 7).
Na2CO3 + Н2О D NaНСО3 + NaOH
2Na+ + 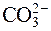 + HOH D HCO3– + 2Na+ + OH–
+ HOH D HCO3– + 2Na+ + OH–
среда щелочная рН > 7.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В соответствии с законом действующих масс гидролиз по аниону протекает тем интенсивнее, чем слабее кислота.
Если соль образована катионом слабого основания и анионом сильной кислоты, то происходит гидролиз по катиону, а среда становится кислотной.
Примером служит процесс взаимодействия с водой нитрата меди (II) Сu(NO3)2. Гидролиз в этом случае обусловлен образованием малодиссоциирующих частиц (CuOH)+. В результате равновесие электролитической диссоциации воды смещается вправо и в растворе появляется избыток ионов водорода, поэтому реакция среды становится кислой (рН < 7). Очевидно, чем слабее основание, тем полнее идет гидролиз.
|
|
