
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородный показатель среды.
|
|
Глава 9
Водородный показатель среды. Гидролиз солей.
Водородный показатель среды.
Вода является слабым электролитом. Обратимый процесс диссоциации этого электролита можно представить следующим уравнением:
Н2О D Н+ + ОН–.
Значение константы диссоциации позволяет судить о том, что равновесие процесса диссоциации воды смещено в сторону исходных веществ.
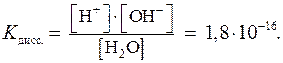
Концентрацию воды [Н2О] в знаменателе предыдущей дроби можно считать величиной постоянной и равной:
[Н2О] = 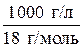 = 55, 56 моль/л.
= 55, 56 моль/л.
Таким образом,
[Н2О] ∙ К дисс. = [Н+]∙ [ОН ] = 55, 56 ∙ 1, 8 ∙ 10–16 = 10–14.
Эту величину, представляющую собой произведение концентраций ионов водорода на концентрацию ионов гидроксила называют ионным произведением воды, или константой воды Kw:
Кw = [Н+]∙ [ОН ] = 10–14.
Ионное произведение воды Kw является постоянной величиной как для чистой воды, так и для разбавленных растворов любых электролитов.
Величина ионного произведения воды увеличивается при повышении температуры.
В чистой воде концентрации гидроксид – ионов и ионов водорода равны:

 [Н+] = [ОН] = √ Kw = √ 10–14 = 10–7 моль/л.
[Н+] = [ОН] = √ Kw = √ 10–14 = 10–7 моль/л.
Для оценки реакции среды была введена специальная величина – водородный показатель среды, или рН, представляющая собой логарифм концентрации ионов Н+ с обратным знаком:
рН = – lg [H+].
Для чистой воды:
рН = – lg10–7 = 7.
Если в растворе концентрация ионов Н+ больше, чем 10–7 моль/л, то рН такого раствора будет меньше 7, что является показателем кислой среды раствора.
Если [Н+] < 10–7 моль/л, то рН > 7 и раствор имеет щелочную реакцию среды.
Логарифм концентрации ионов ОН– с обратным знаком называется гидроксильным показателем .
р ОН = – lg [ОH–].
|
|
