
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ВВЕДЕНИЕ. Химическая кинетика и равновесие
|
|
Химическая кинетика и равновесие
У химика, пытающегося осуществить ту или иную химическую реакцию, возникает прежде всего два вопроса. Во-первых, насколько быстро идёт данная химическая реакция и, во-вторых, насколько полно протекает она. Ответ на первый вопрос даёт учение о скоростях химических реакций (химическая кинетика), на второй вопрос – учение о химическом равновесии (химическая термодинамика).
Для поиска ответа на поставленные вопросы необходимо определиться с объектом исследования – системой, под которой понимают мысленно обособленную часть пространства, заполненного веществами, между которыми может происходить интересующая нас химическая реакция. С точки зрения агрегатного состояния этих веществ система может быть гомогенной (когда все вещества или представляют собой смешивающиеся между собой жидкости), либо гетерогенной (часть веществ являются газообразными, другие твёрдые или жидкие). С точки зрения границ, внутри которых находятся рассматриваемые вещества, система может быть замкнутой, открытой, термически изолированной или неизолированной.
1 Скорость химической реакции (основные положения химической кинетики)
Под скоростью химической реакции понимают изменение концентраций реагирующих или образующихся веществ в единицу времени
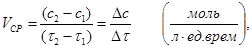 (1)
(1)
Вполне понятно, что концентрация исходных веществ по мере протекания химической реакции будет уменьшаться (c2< c1), а концентрация конечных веществ будет увеличиваться (c2> c1). Но скорость химической реакции величина всегда положительная, поэтому Δ с должно быть всегда положительным. Очевидно также, что если для реакции
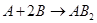 (2)
(2)
определять скорость по изменению концентрации веществ A или B, то найденные значения скоростей будут отличаться друг от друга в два раза. Обычно о скорости химической реакции судят по изменению концентрации вещества А. Соотношение (1) даёт значение средней скорости за промежуток времени Δ τ. Истинная скорость химической реакции – это производная концентрации по времени
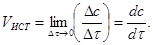 (3)
(3)
Значения скоростей химических реакций могут меняться в очень широких пределах, от практически мгновенно протекающих (взрывообразные, ионные взаимодействия в растворах) до реакций, протекающих в течение нескольких лет и даже столетий. Скорость реакции зависит от природы и концентрации реагирующих веществ, давления, температуры, степени дисперсности веществ (при протекании реакции с участием твёрдых веществ), наличия или отсутствия катализатора. Рассмотрим влияние этих факторов более подробно.
1.1 Влияние природы и концентрации реагирующих веществ
При протекании химической реакции между двумя газообразными веществами (например, 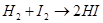 ) необходимым (но недостаточным!) условием взаимодействия веществ является столкновение молекул H2 и I2 между собой. Число таких столкновений в единицу времени будет пропорционально количеству молекул взаимодействующих веществ в единице объёма, т.е. концентрации взаимодействующих веществ.
) необходимым (но недостаточным!) условием взаимодействия веществ является столкновение молекул H2 и I2 между собой. Число таких столкновений в единицу времени будет пропорционально количеству молекул взаимодействующих веществ в единице объёма, т.е. концентрации взаимодействующих веществ.
На основании рассмотренных выше соображений был установлен закон действующих масс (ЗДМ) – скорость химических реакций пропорциональна произведению концентраций реагирующих веществ (Гульдберг и Вааге, 1867г.). Его математическое выражение для реакции
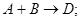 (4)
(4)
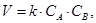 (5)
(5)
где CА и СВ – текущие концентрации веществ А и В, k – коэффициент пропорциональности называют константой скорости химической реакции.
Физический смысл k определяется, исходя из выражения (5): k – это скорость химической реакции, когда концентрации реагирующих веществ или их произведения равны единице. Константа скорости k зависит от природы взаимодействующих веществ, температуры, наличия или отсутствия катализатора.
Если в уравнении реакции имеются вещества со стехиометрическими коэффициентами, отличными от единицы, то в выражение ЗДМ концентрация данного вещества берётся в степени, равной его стехиометрическому коэффициенту. Например, для реакции взаимодействия газообразных веществ по уравнению (2) скорость реакции будет определяться выражением
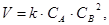 (6)
(6)
Когда в химической реакции одно и то же из реагирующих веществ является твёрдым, то реакция идёт лишь на поверхности этого вещества и понятие «концентрация твёрдого вещества» в данном случае не имеет физического смысла. Конечно же, скорость реакции зависит от степени дисперсности (раздробленности) этого вещества, но это не находит отражения в выражении ЗДМ. Поэтому концентрация твёрдых веществ не включается в уравнения ЗДМ. Например, для процесса
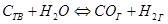 (7)
(7)
скорость прямой реакции определяется выражением
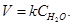 (8)
(8)
1.2 Влияние давления
Влияние давления на скорость химических реакций проявляется в том случае, когда в реакции участвуют газообразные вещества. Так как для газов их концентрация пропорциональна давлению, то скорость химической реакции будет пропорциональна давлению в степени, равной сумме стехиометрических коэффициентов для веществ, находящихся в газообразном состоянии. Например, для (7) скорость прямой реакции будет пропорциональна давлению, а для обратной реакции пропорциональна квадрату давления.
Учитывая пропорциональность концентрации газообразных веществ давлению для реакций с участием газов, в выражении ЗДМ можно заменить концентрации на парциальные давления. Например, для реакции (4)
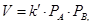 (9)
(9)
где РА и РВ – парциальные давления газообразных веществ А и В соответственно.
Константа скорости химической реакции k’ будет уже иметь другое значение по сравнению со значением k в уравнении (5).
1.3 Молекулярность и порядок химической реакции
Различают моно-, ди-, три- (и т.д.) молекулярные реакции. Молекулярность химической реакции определяется числом молекул исходных веществ, участвующих в элементарном акте химического взаимодействия. Наиболее часто встречаются моно- и димолекулярные реакции. Вероятность одновременного соударения трёх молекул весьма мала, поэтому тримолекулярные реакции достаточно редки, а реакции с большей, чем тримолекулярностью практически неизвестны.
В подавляющем большинстве случаев формальная запись уравнения химической реакции не соответствует её истинной молекулярности. Например, реакция
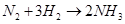 (10)
(10)
формально четырёхмолекулярна. Но такие реакции, как отмечалось выше, неизвестны.
Уравнение (10) является суммирующим, включающим в себя несколько последовательно протекающих химических реакций. Общая скорость данной реакции будет определяться изменением концентрации веществ для самого медленного протекающего промежуточного химического процесса. Поэтому в экспериментально определяемых зависимостях скоростей химической реакции от концентрации реагирующих веществ степень при концентрациях исходных веществ в выражении ЗДМ отличается от стехиометрических коэффициентов суммарной записи уравнения химической реакции. Эта экспериментально выявляемая степень при концентрации в выражении ЗДМ носит название порядка химической реакции по данному компоненту. Порядок реакции может быть дробным и даже нулевым. Суммирование порядков по отдельным компонентам даёт общий порядок химической реакции.
1.4 Влияние температуры
Факт сильного влияния температуры на скорость химических реакций был установлен ещё в XIX веке Вант-Гоффом. Он сформулировал эмпирическое правило, носящее его имя: «при увеличении температуры на 100 скорость химической реакции увеличивается в 2-4 раза». Величина, показывающая во сколько раз увеличивается скорость химической реакции при повышении температуры на 100, носит название температурного коэффициента скорости химической реакции (γ). Очевидно, что
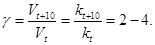 (11)
(11)
Если известно значение γ для какой-либо химической реакции, то скорость реакции при температуре t2 связана со скоростью при температуре t1 соотношением
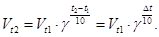 (12)
(12)
Сильную зависимость скорости химической реакции от температуры нельзя объяснить увеличением числа столкновений молекул между собой с ростом температуры. Согласно кинетической теории газов число столкновений молекул в газе пропорционально корню квадратному из абсолютной температуры. Поэтому при увеличении температуры на 100 число столкновений возрастает в диапазоне температур 200-10000 в 1, 01-1, 02 раза (т.е. на 1-2%), в то же время скорость возрастает в 2-4 раза (т.е. на 200-400%).
Причина в другом – в резком возрастании с температурой числа «успешных столкновений», т.е. столкновений, которые заканчиваются образованием новых молекул. Для реализации успешного столкновения необходимо, чтобы сталкивающиеся молекулы обладали бы необходимым минимальным запасом энергии, который тратится на частичный разрыв химических связей в исходных молекулах, и лишь после этого происходит образование новых молекул. Этот минимальный запас энергии носит название энергии активации химической реакции (Еакт). При этом чем меньше Еакт, тем выше скорость химической реакции и, наоборот, с увеличением Еакт скорость уменьшается.
Таким образом для осуществления химической реакции необходимо, чтобы исходная система преодолела энергетический барьер, равный энергии активации химической реакции. При этом система проходит через некое промежуточное состояние, соответствующее образованию так называемого активированного (промежуточного) комплекса. Время жизни его очень мало, при его распаде система переходит в конечное состояние. Разница в энергии системы в исходном и конечном состояниях равна тепловому эффекту химической реакции (Δ Н). Графически это представлено на рис. 1, где по оси ординат отложена энергия системы, в которой происходит реакция
 (13)
(13)
а по оси абсцисс – координата реакции (скорость реакции, концентрация любого из компонентов или время протекания реакции).
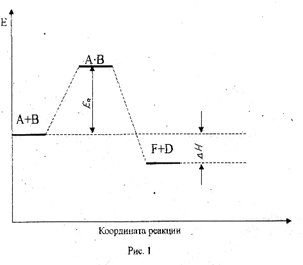
A· B – промежуточный или активированный комплекс.
Математическая связь между скоростью химической реакции, вернее между константой скорости химической реакции и температурой, даётся уравнением Аррениуса:
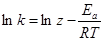 или (14)
или (14)
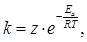
где z – носит название предэкспоненциального множителя или фактора, отражающего в первом приближении общее число столкновений молекул реагирующих веществ. Однако не каждое столкновение молекул, обладающих достаточным для реакции запасом энергии, заканчивается актом химического взаимодействия, так как в момент соударения молекулы реагирующих веществ могут быть ориентированы неблагоприятным для взаимодействия образом. Это обстоятельство отражается величиной энтропии активации Sa, которая тем больше, чем большее число способов ориентации молекул реагирующих веществ при их столкновении благоприятно для акта химического взаимодействия.
С учётом этого уравнение Аррениуса приобретает вид:
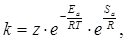 (15)
(15)
в котором множитель 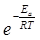 определяет долю молекул, обладающих достаточным для реакции запасом энергии, а множитель
определяет долю молекул, обладающих достаточным для реакции запасом энергии, а множитель 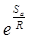 характеризует долю молекул с благоприятной для взаимодействия ориентацией.
характеризует долю молекул с благоприятной для взаимодействия ориентацией.
Таким образом, скорость химической реакции тем больше, чем больше температура, меньше энергия активации Ea и больше энтропия активации Sa.
1.5 Влияние катализатора на скорость химических реакций
Катализаторами называют вещества, ускоряющие химическую реакцию, но сами при этом не изменяющиеся ни в количественном, ни в качественном отношении. Само явление ускорения химических реакций под действием катализаторов называют катализом.
Различают гомо- и гетерогенный катализ. В первом случае реагирующие вещества и катализатор находятся в одном и том же агрегатном состоянии (чаще всего газообразном или жидком, причём жидкости смешиваются между собой, либо в растворённом состоянии в одном и том же растворителе). Во втором случае реагирующие вещества находятся в газообразном или жидком агрегатном состоянии, а катализатор – в твёрдом агрегатном состоянии. Для объяснения гомогенного катализа чаще всего используют теорию образования промежуточных соединений, а для гетерогенного катализа – теорию активированной абсорбции.
Суть теории образования промежуточных соединений легко понять из следующих соображений. При необходимости осуществления реакции
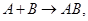 (16)
(16)
которая идёт либо очень медленно, либо вообще не происходит (очень высокое значение Еакт), добавление катализатора К резко ускоряет этот процесс вследствие лёгкого протекания реакций
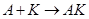 и
и 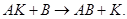 (17)
(17)
 Энергии активации для реакций (17) значительно меньше, чем для (16). Легко можно видеть, что количество катализатора при этом остаётся неизменным. Графически это представлено на рис. 2, откуда легко можно видеть, что при добавлении катализатора высокий энергетический барьер для реакции (16) – Еакт заменяется на значительно более низкие - Еакт’ и Еакт’’ для реакции (17). Примером подобного каталитического процесса является получение серной кислоты по нитрозному методу, где катализатором являются оксиды азота.
Энергии активации для реакций (17) значительно меньше, чем для (16). Легко можно видеть, что количество катализатора при этом остаётся неизменным. Графически это представлено на рис. 2, откуда легко можно видеть, что при добавлении катализатора высокий энергетический барьер для реакции (16) – Еакт заменяется на значительно более низкие - Еакт’ и Еакт’’ для реакции (17). Примером подобного каталитического процесса является получение серной кислоты по нитрозному методу, где катализатором являются оксиды азота.
Объяснение гетерогенного катализа с точки зрения теории активированной абсорбции включает в себя рассмотрение стадии адсорбции (поглощения) исходных веществ поверхностью раздела фаз газ - твёрдое, далее взаимодействие активированных под действием адсорбции молекул исходных веществ и десорбции получающихся веществ с поверхности катализатора. Активирование молекул исходных веществ при адсорбции происходит за счёт сил межмолекулярного взаимодействия этих молекул с молекулами катализатора, находящимися на его поверхности. В качестве примера гетерогенного катализа можно привести процесс получения серного ангидрида контактным методом с помощью катализатора V2O5 с добавками оксидов тяжёлых металлов.
|
|