
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие. Большинство химических процессов является обратимыми
|
|
Большинство химических процессов является обратимыми. В таких системах одновременно протекают прямая и обратная химические реакции, например
 (18)
(18)
Согласно ЗДМ скорость прямого химического процесса определяется выражением
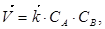 (19)
(19)
а обратного
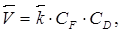 (20)
(20)
где 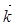 и
и 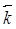 - константы скоростей прямой и обратной химических реакций соответственно и С с соответствующим индексом – концентрация исходных и конечных веществ в моль/л.
- константы скоростей прямой и обратной химических реакций соответственно и С с соответствующим индексом – концентрация исходных и конечных веществ в моль/л.
При равенстве скоростей прямого и обратного химических процессов система становится равновесной. Химическое равновесие – это не состояние покоя, а динамическое состояние системы, когда идут прямые и обратные процессы, но они взаимно компенсируют друг друга.
При 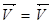
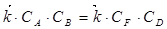 или (21)
или (21)
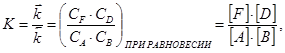
где квадратными скобками обозначены равновесные концентрации веществ. Они не могут принимать любые, не зависящие друг от друга значения, так как связаны между собой соотношением (21). Отношение двух постоянных величин 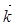 и
и 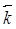 заменено постоянной величиной К, которая носит название константы химического равновесия.
заменено постоянной величиной К, которая носит название константы химического равновесия.
Значение константы химического равновесия определяет глубину протекания химического процесса. Если К равно единице, процесс протекает на 50%. При исходной концентрации веществ А и В, равной 1 моль/л (концентрации F и D равны нулю), равновесные концентрации всех компонентов будут равны 0, 5 моль/л, т.е. [A]=[B]=[F]=[D]=0, 5. При К, равных 102, 104, 106, глубина протекания прямого процесса будет составлять соответственно 91, 0; 99, 0; 99, 9%, а обратного процесса (константы равновесия будут составлять 10-2, 10-4, 10-6) – 9, 0; 1, 0; 0, 1%. Обычно говорят, что при преобладании концентрации конечных веществ по сравнению с исходными химическое равновесие (18) смещено вправо (в сторону конечных веществ), в обратном случае – влево (в сторону исходных веществ). Для того, чтобы ответить на вопрос, каким образом обеспечить максимальную полноту протекания химического процесса при заданных условиях, необходимо рассмотреть влияние на положение химического равновесия различных факторов (концентрации, давления, температуры).
2.1 Влияние концентрации
Величина К не зависит от концентрации веществ, участвующих в равновесии. Поэтому, если ввести в равновесную систему дополнительное количество, например, исходных веществ (т.е. при этом увеличивается знаменатель в выражении (21)), то для того, чтобы значение К оставалось бы постоянным, должна увеличиться концентрация конечных веществ (т.е. увеличиться числитель в выражении (21)). Таким образом результатом внешнего воздействия (увеличение концентрации одного (или обоих) исходных веществ) является смещение равновесия (18) вправо. Аналогично можно определить, как будут влиять на положение химического равновесия любые другие изменения концентрации любых компонентов.
Вывод: увеличение концентрации исходных веществ или уменьшение концентрации конечных веществ смещает равновесие вправо и, наоборот, уменьшение концентрации исходных веществ или увеличение концентрации конечных веществ сдвигает равновесие влево. Важно подчеркнуть, что равновесная система как бы противодействует внешнему воздействию. На увеличение (уменьшение) концентрации одного из компонентов система реагирует увеличением интенсивности протекания той реакции, в результате которой концентрация этого компонента уменьшается (увеличивается), т.е. этот компонент расходуется (получается) при данной реакции. Отметим также, что изменение количества твёрдых веществ, участвующих в равновесии, на положение химического равновесия не влияет.
2.2 Влияние давления
О влиянии давления на положение химического равновесия можно говорить тогда, когда в равновесии участвуют газообразные вещества. Изменение давления при этом равносильно изменению концентрации реагирующих и образующихся веществ, так как концентрация газообразных компонентов пропорциональна давлению.
При этом, если химический процесс не сопровождается изменением числа молей газообразных веществ, то давление не влияет на химическое равновесие. Например, для реакции
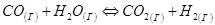 (22)
(22)
количество молей газообразных веществ не меняется. Скорости прямой (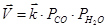 ) и обратной (
) и обратной (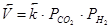 ) химических реакций в равной степени будут меняться при изменении давления. В то же время для равновесия
) химических реакций в равной степени будут меняться при изменении давления. В то же время для равновесия
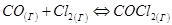 (23)
(23)
увеличение давления, например, в два раза приведёт к повышению скорости прямой реакции в 4 раза (так как 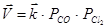 ), а обратной реакции только в 2 раза (так как
), а обратной реакции только в 2 раза (так как 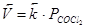 ). Следовательно, равновесие (23) при увеличении давления сместится в сторону образования COCl2.
). Следовательно, равновесие (23) при увеличении давления сместится в сторону образования COCl2.
Вывод: если химическая реакция не сопровождается изменением числа молей газообразных веществ, то давление не влияет на химическое равновесие, в остальных случаях увеличение (уменьшение) давления смещает равновесие в сторону образования газообразных продуктов, занимающих меньший (больший) объём. Опять же важно подчеркнуть, что равновесная система противодействует внешнему воздействию – изменению давления, компенсируя его изменение. Сдвиг равновесия при увеличении давления в сторону газообразных продуктов, занимающих меньший объём, приводит к понижению давления, так как меньшее количество молей газов будут производить меньшее давление, и наоборот.
2.3 Влияние температуры
Влияние температуры на положение химического равновесия обусловлено тем, что температура по-разному влияет на скорость прямой и обратной химических реакций. Повышение (понижение) температуры увеличивает (уменьшает) скорость прямой и обратной реакции, но в разное количество раз.
Согласно правилу Вант-Гоффа, повышение температуры вызывает интенсификацию протекания эндотермических химических процессов, а понижение температуры – экзотермических процессов. Следовательно, если прямая реакция экзотермическая, то увеличение температуры приведёт к смещению равновесия в сторону образования исходных веществ (так как обратная реакция будет эндотермической), а уменьшение температуры – в сторону конечных веществ. Опять же следует подчеркнуть противодействие равновесной системы действию внешнего фактора – изменению температуры. Рост температуры интенсифицирует протекание эндотермических реакций, приводящих к понижению температуры, и наоборот.
2.4 Принцип Ле-Шателье – Брауна. Оптимальные условия осуществления химического процесса
Влияние всех вышеперечисленных факторов (концентрации, давления, температуры) можно объединить в виде единого правила, получившего название принципа Ле-Шателье – Брауна или принципа подвижного равновесия. Существуют различные формулировки его. Одна из наиболее распространённых: если в равновесной системе изменить одно из внешних условий, влияющих на положение химического равновесия (концентрацию, давление или температуру), то в системе усилятся процессы, приводящие к компенсации внешнего воздействия. При этом система переходит из одного равновесного состояния в другое, отвечающее новым условиям. Обусловлено это тем, что воздействие внешних факторов по-разному изменяет скорости прямого и обратного химических процессов.
Рассмотрим приложение принципа Ле-Шателье – Брауна для конкретного химического равновесия
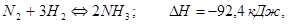 (24)
(24)
Увеличение концентрации N2 и H2 или уменьшение концентрации NH3 вызовет противодействие системы, которая будет проявляться в уменьшении концентрации N2 и H2 и увеличении концентрации NH3 за счёт более интенсивного протекания процесса слева направо. Обратный процесс усилится при увеличении концентрации NH3 и уменьшении концентрации N2 и H2.
Повышение внешнего давления вызовет сдвиг химического равновесия в сторону образования NH3, так как два моля аммиака будут производить меньшее давление, чем четыре моля газообразных веществ слева (1 моль азота + 3 моля водорода). Обратный эффект, т.е. сдвиг равновесия в сторону исходных веществ, вызовет уменьшение внешнего давления.
Реакция синтеза аммиака является экзотермическим процессом (знак «-» соответствует выделению тепла системой). Поэтому повышение температуры усилит протекание эндотермического процесса, т.е. реакцию разложения аммиака на азот и водород. И, наоборот, понижение температуры вызовет сдвиг химического равновесия вправо, в сторону образования аммиака, т.е. усиление экзотермического процесса будет противодействовать внешнему фактору – понижению температуры.
Исходя из вышеизложенного, можно определить оптимальные условия осуществления синтеза аммиака (получения его с максимальным выходом). Во-первых, повышение концентрации исходных веществ (причём концентрация Н2 влияет на выход NH3 в большей степени, так как входит в выражение ЗДМ в третьей степени) и понижение концентрации аммиака (путём его вывода из системы, например, конденсацией). Во-вторых, использование высоких давлений при проведении процесса. Верхний предел используемых давлений определяется свойствами конструкционного материала, из которого изготовлен реакционный аппарат. В-третьих, проведение реакции синтеза аммиака при возможно низких температурах. Это будет способствовать повышению выхода аммиака.
Однако уменьшение температуры будет вызывать резкое уменьшение скорости реакции синтеза аммиака. В данном случае реакция взаимодействия азота с водородом при обычно используемых давлениях в несколько сот атмосфер (107Па) начинает идти с заметной скоростью при температурах 600-650 0С, но при этом равновесие практически полностью смещено влево, выход аммиака весьма незначительный. Ниже 600 0С скорость реакции синтеза аммиака практически равна нулю. Использование температуры порядка 450 0С, при которой равновесие синтеза аммиака практически полностью смещено вправо, становится проблематичным.
Выход из создавшегося положения – использование катализатора (в данном случае специальным образом восстановленного железа), который позволяет при более низких температурах резко увеличивать скорость химической реакции между H2 и N2. Таким образом с помощью катализатора процесс синтеза аммиака осуществляют при 450 0С и повышенных давлениях, т.е. в условиях, когда химическое равновесие (24) полностью смещено в желаемую для нас сторону.
Следует подчеркнуть отличие в действии на равновесную систему температуры и катализатора. Увеличение температуры повышает скорости прямой и обратной химических реакций в разное количество раз и тем самым смещает химическое равновесие, часто в нежелательную для нас сторону. В то же время катализатор увеличивает скорости обеих реакций в одинаковое количество раз и таким образом не вызывает смещения химического равновесия.
|
|