
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основной закон кинетики.
|
|
Зависимость скорости химической реакции от концентрации Сi определяется основным законом кинетики согласно которому Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD +... ––> еЕ +...
можно записать:
 (3.5)
(3.5)
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (3.5) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции.
Для того чтобы найти общий порядок реакции, достаточно в эксперименте исходные вещества (реагенты) взять в стехиометрическом соотношении. Порядок реакции по данному реагенту можно определить, взяв все остальные реагенты в таком избытке, что их изменением можно пренебречь.
При этом общий порядок реакции по данному реагенту можно рассчитать, используя:
а) метод, основанный на зависимости начальной скорости реакции от исходной концентрации реагентов;
б) метод, основанный на зависимости изменяющейся во времени скорости реакции от концентрации реагента.
Рассмотрим эти два метода на примере реакции
А + В → С + D
При использовании первого метода проводят серию опытов с различными исходными концентрациями реагента А (СА, 0), снимая зависимость СА(τ).
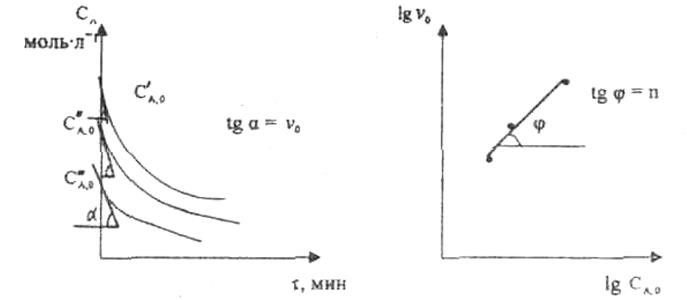
Рис. 3.4 Рис. 3.5
Для каждого опыта определяют известными методами начальную скорость реакции и по уравнению
 , (3.6)
, (3.6)
графическим или аналитическим методом определяют порядок реакции.
порядок реакции равен тангенсу угла наклона прямой к оси 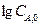
При применении второго метода в начале определяют в различные моменты времени концентрацию реагента А(СА). Затем строят график зависимости СА(τ), по которому для различных моментов времени находят скорости реакции.
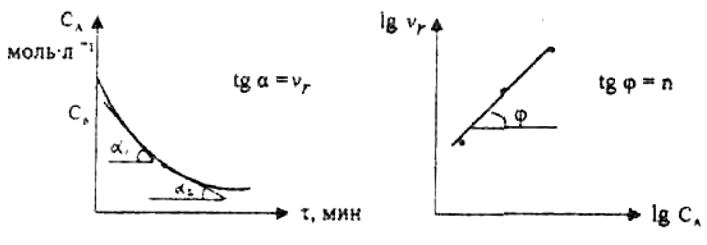
Рис. 3.6 Рис. 3.7
После этого используя известное уравнение
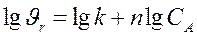 , (3.7)
, (3.7)
графическим или аналитическим методом определяют порядок реакции.
порядок реакции равен тангенсу угла наклона прямой к оси 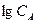 .
.
графическим или аналитическим методом определяют порядок реакции.
3.2. Зависимость скорости реакции от температуры.
Скорость химической реакции обычно растет с повышением температуры.Первая попытка учесть влияние температуры была сделана Я. Г. Вант-Гоффом, который сформулировал следующее эмпирическое правило:
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ. Математически правило Вант-Гоффа можно записать следующим образом:
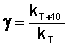 (3.8)
(3.8)
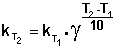 (3.9)
(3.9)
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции.
Рассмотрим термодинамический вывод выражения, описывающего зависимость константы скорости реакции от температуры и величины энергии активации – уравнения Аррениуса. Согласно уравнению изобары Вант-Гоффа,
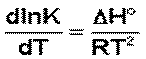 (3.10)
(3.10)
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (3.10) следующим образом:
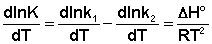 (3.11)
(3.11)
Представив изменение энтальпии реакции Δ Hº в виде разности двух величин E1 и E2, получаем:
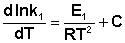 (3.12)
(3.12)
 (3.13)
(3.13)
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
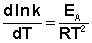 (3.14)
(3.14)
После неопределенного интегрирования выражения (3.14) получим уравнение Аррениуса в интегральной форме:
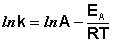 (3.15)
(3.15)
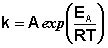 (3.16)
(3.16)
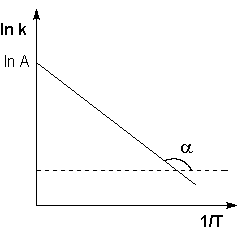
Рис. 3.8 Зависимость логарифма константы скорости химической реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (3.16) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (3.14), логарифм константы скорости линейно зависит от обратной температуры (рис.3.8); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
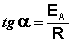 (3.17)
(3.17)
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
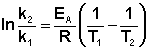 (3.18)
(3.18)
|
|