
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислая;
|
|
3) нейтральная;
4) сильнощелочная
33. Уравнение: 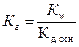 для соли:
для соли:
1) NH4CH3COO;
2) NH4NO3;
3) NaCN;
4) KCl
34. Сокращённое ионное уравнение HCO3- + H2O«Н2СО3 + ОН- соответствует гидролизу соли::
1) КCH3COO;
2) Nа2CO3;
3) КHCO3;
4) ZnCO3
35. Формула 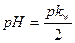 соответствует гидролизу соли:
соответствует гидролизу соли:
1) KF;
2) NаNO3;
3) NH4CH3COO;
4) MgCl2
36. Совместный гидролиз протекает в случае:
1) Nа2СO3, NаСl;
2) AlCl3, Nа2СO3;
3) KCN, NH4Cl;
4) NH4CH3COO, CuSO4
37. Гидролизу не подвергается соль:
1) ZnSO4;
2) K2S;
NaBr;
4) K2HPO4
38. Уравнение для расчёта 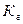 соли, образованной слабым основанием и слабой одноосновной кислотой это:
соли, образованной слабым основанием и слабой одноосновной кислотой это:
1) 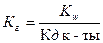 ;
;
2) 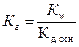 ;
;
3) 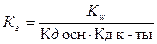 ;
;
4) 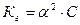
39. РН после гидролиза соли NH4Cl при увеличении концентрации соли в 10 раз:
1) увеличится;
Уменьшится;
3) будет равно рН воды;
4) не изменится
40. Усилить гидролиз соли NaCH3COO можно добавление:
1) NaOH;
2) KCN;
HCl;
4) KCl
41. Кислую среду, имеет водный раствор:
1) KCl;
2) Nа2S;
3) NH4CH3COO;
4) FeCl3
42. Формула 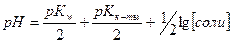 применима для соли:
применима для соли:
1) Na2CO3;
2) NH4ClO4;
3) ZnSO4;
4) NH4CN
43. Ослабление гидролиза соли KNO2 происходит при добавлении:
NaOH;
2) повышение температуры;
3) HCl;
4) KCl
44. Нейтральную среду имеет водный раствор соли:
1) KClO;
2) KNO2;
3) Mg(NO3)2;
4) NH4CH3COO
45. Следствием гидролиза является:
1) разбавление раствора;
2) изменение активной концентрации ионов соли;
3) образование слабого электролита (электролитов);
4) изменение ионной силы раствора
46. Гидролизу соли, образованной слабой кислотой и сильным основанием, отвечает уравнение:
1) СН3СОО- + Н2О «СН3СООН + ОН-;
2) NH4 + H2O «NH4OH + H+;
3) NH4+ + CH3COO- + H2O «NH4OH + CH3COOH;
4) Al3+ + H2O «AlOH2+ + H+
47. Уравнение для расчета рН соли образованной слабой одноосновной кислотой и однокислотным сильным основанием (NaCN, CH3COOК, KNO2
1) рН = 7 + ½ рКк + ½ lgCc;
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
2) рН = 7 + ½ рКк - ½ pKосн;
3) рН = 7 - ½ рКосн - ½ lg Cc;
4) рН = 7 + ½ рКк + ½ рКосн - ½ lg2
48. Усилить гидролиз соли KCN можно добавлением:
1) NaOH;
2) KCl;
HCl;
4) CH3COONa
49. Совместному необратимому гидролизу подвергаются соли:
1) AlCl3 и Na2CO3;
2) KCN и CH3COONH4;
3) FeCl3 и NH4Cl;
4) NH4CN и NH4Cl
50. Гидролиз соли, образованной сильной кислотой и слабым основанием, соответствует уравнению:
1) HCOO- + HOH «OH- + HCOOH;
2) NH4+ + HOH «H+ + NH4OH;
3) NH4+ + CN- + HOH «NH4OH + HCN;
4) Al3+ + 3CH3COO- + HOH «AlOH(CH3COO)- + CH3COOH
51. Не подвергаются гидролизу соль:
1) Na2S;
2) AlCl3;
3) NaNO3;
4) Na2CO3
52. Гидролиз АТФ в организме - источник:
1) ионов водорода;
2) белков;
3) воды;
|
|
