
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теория активного комплекса (так)
|
|
Более совершенной является теория переходного состояния, в которой в качестве условия возможности протекания реакции рассматривается не столкновение двух молекул, а образование ими непрочного промежуточного комплекса, что позволяет сразу учесть необходимость определенной ориентации реагирующих молекул. Энергия системы зависит от взаимного расположения (конфигурации) атомов и сил взаимодействия между ними. Сама химическая реакция рассматривается как переход от начальной конфигурации атомов (исходные вещества) к конечной (продукты реакции) при непрерывном изменении соответствующих координат (межатомных расстояний, валентных углов). В ходе этого процесса непрерывно изменяется энергия всей системы, при этом всегда образуется некоторая промежуточная конфигурация атомов, соответствующая максимуму потенциальной энергии системы, - эту конфигурацию и называют активным (промежуточным) комплексом. Активный комплекс не является, в отличие от обычной молекулы, устойчивой частицей, так как соответствует максимуму, а не минимуму потенциальной энергии.
Рассмотрим с позиций теории переходного комплекса реакцию между молекулой АВ и атомом С:
АВ + С Û [ А... В... С ]¹ ® А + ВС.
Данную реакцию формально можно представить в виде двух последовательных стадий: разрыва связи А - В и образования связи В - С. В действительности эти стадии не происходят по отдельности: атом С при сближении с молекулой АВ начинает взаимодействовать с атомом В, в результате связь А - В слабеет (расстояние между атомами А и В увеличивается), при дальнейшем усилении связи В - С связь А - В все более слабеет до тех пор, пока не образуется молекула ВС (атомы А и В находятся на таком расстоянии, что практически не взаимодействуют друг с другом).
Изменение энергии системы при переходе от исходных к конечным веществам представлено на рис. Энергия переходного комплекса выше энергии исходных веществ на величину Δ Е 0, которая представляет собой энергию активации реакции.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
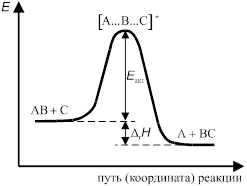
Рис. Изменение потенциальной энергии вдоль координаты реакции.
Согласно теории переходного комплекса между исходными веществами и комплексом устанавливается равновесие. Константа этого равновесия равна
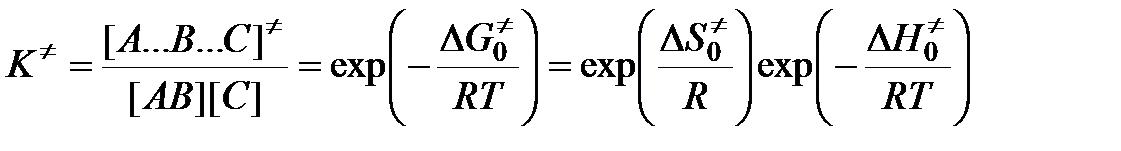 ,
,
где  ,
, 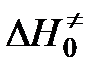 и
и  — свободная энергия, энтальпия и энтропия образования переходного комплекса из исходных веществ,
— свободная энергия, энтальпия и энтропия образования переходного комплекса из исходных веществ,
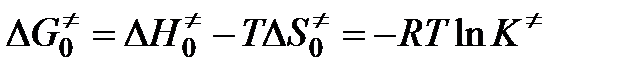 .
.
Скорость образования конечного продукта ВС можно выразить двояким образом. Во-первых, как скорость бимолекулярной реакции
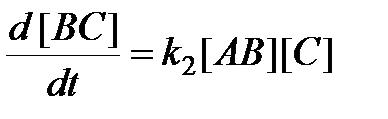 .
.
Во-вторых, как скорость разложения переходного комплекса:
 ,
,
где c¹ — константа скорости распада переходного комплекса. Тогда
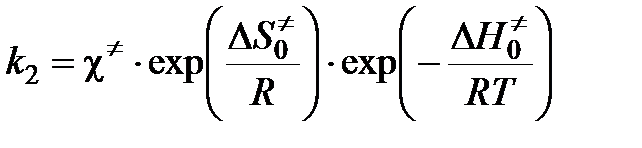 .
.
Чтобы получить окончательное выражение для константы скорости бимолекулярной реакции, необходимо знать константу скорости распада переходного комплекса. Полагают, что эта константа равна частоте колебаний разрывающейся “критической” связи в комплексе (в данном случае связи А - В). Подробная теория переходного состояния дает для этой частоты величину kT / h, где k — константа Больцмана, h — постоянная Планка. Тогда
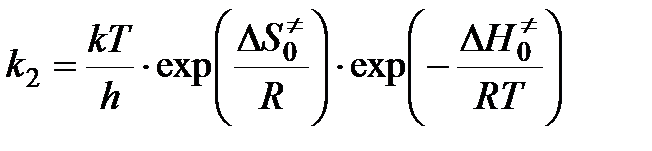 ,
,
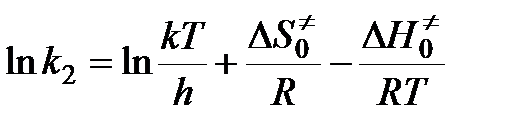 .
.
С другой стороны, по уравнению Аррениуса
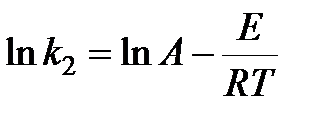 .
.
Тогда
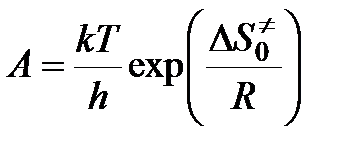 ,
, 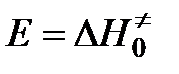 .
.
Значение этого уравнения состоит в том, что оно объясняет причины существования низких величин предэкспоненциального множителя, для учета которых в теории активных столкновений молекул вводится стерический фактор Р
 .
.
Величина А зависит от энтропии образования переходного комплекса. В рассматриваемом случае образование одной частицы активного комплекса из двух частиц (молекулы АВ и атома С) должно сопровождаться уменьшением энтропии, т. е.
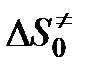 < 0,
< 0, 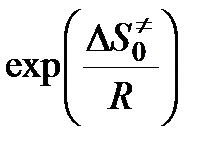 < 1.
< 1.
Так, например, если  = -25 Дж/(моль·К), то
= -25 Дж/(моль·К), то
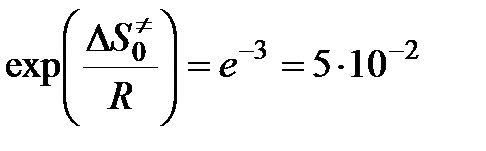 ,
,
что делает понятным появление малых стерических множителей в теории активных столкновений.
Энергия активации в теории переходного состояния заменяется изменением энтальпии  , а энтропийный сомножитель
, а энтропийный сомножитель 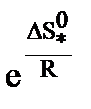 - энтропия активации, тесно связана со строением исходных молекул и активного комплекса. Например, разрушение сложных молекул и образование более простого активного комплекса ведет к росту “беспорядка” в системе и сопровождается повышением энтропии.
- энтропия активации, тесно связана со строением исходных молекул и активного комплекса. Например, разрушение сложных молекул и образование более простого активного комплекса ведет к росту “беспорядка” в системе и сопровождается повышением энтропии.
Зависимость скорости реакции не только от энергии активации, но и от энтропии активации, позволяет объяснить существование медленных реакций, имеющих малую энергию активации, быстрых реакций с большой энергией активации, различие скоростей реакции с одинаковыми энергиями активации.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Теория активного комплекса применима к реакциям, протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции, протекающие в газовой фазе. Дело в том, что молекулы реагентов в жидкости находятся на более близком расстоянии, когда силы взаимодействия между ними нельзя считать малыми или даже отсутствующими, что часто допустимо в газах.
|
|
