
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
II.5. Цепные реакции
|
|
Химические процессы, в которых периодически повторяются элементарные реакции с участием свободных атомов, радикалов или иных активных частиц называются цепными реакциями. По цепному механизму протекают процессы горения, крекинга нефти, многие фотохимические реакции (образование НСl, НВr, СОСl2 и др.), цепные ядерные реакции (распад урана-235 или плутония в ядерном реакторе или бомбе), реакции полимеризации и конденсации при производстве пластмасс и т.д.
Процесс образования свободных атомов или радикалов требует большой энергии активации, но их высокая реакционная способность и возникновение новых активных частиц при реакциях с насыщенными молекулами приводят к тому, что скорость цепных реакций оказывается обычно значительно выше скорости не цепных реакций.
В любой цепной реакции можно выделить три стадии: зарождение цепи, развитие цепи и обрыв цепи. Примером цепной реакции может служить реакция образования хлороводорода из водорода и хлора, схема механизма которой была предложена Нернстом:
Н2 + Сl2 ® 2НСl,
Процесс зарождения цепи:
Cl2 ® Cl + Cl
Эта реакция диссоциации молекулы хлора на атомы может происходить при поглощении света
Cl2 + hn ® Cl + Cl,
термическим путем – при столкновении, например, двух молекул хлора с повышенной энергией:
Cl2 + Cl2 ® Cl + Cl + Cl2,
химическим путем – например, при взаимодействии молекулы хлора с атомом натрия, пары которого введены в систему.
Образующиеся атомы хлора обладают высокой реакционной способностью и вступают в дальнейшее взаимодействие с исходными веществами, протекает вторая группа реакций – развитие цепи:
Cl + H2 ® HCl + H
H + Cl2 ® HCl + Cl
В результате первой реакции появляется атом водорода, который легко вступает во взаимодействие с молекулой хлора, в результате чего образуется хлороводород и регенерируется атом хлора, который дает начало следующему звену:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Cl + H2 ® HCl + H
H + Cl2 ® HCl + Cl
и так далее. В результате возникают последовательно идущие один за другим циклы – развивается цепь реакций
Cl ® H ® Cl ® H ® Cl ®...
При благоприятных условиях такая цепь может состоять из многих тысяч звеньев. В результате на одну первоначально активированную молекулу хлора образуется не две молекулы HCl, как при обычной бимолекулярной реакции, а десятки тысяч молекул. Для приведенной реакции характерным является то, что на одну вступающую в реакцию активную частицу Сl или Н вновь образуется одна активная частица. Такие реакции называют неразветвленными. Если число активных частиц в цепи увеличивается - разветвленные цепные реакции.
Реакции обрыва цепи, приводящие к гибели активных частиц при соударении с какой-либо третьей частицей М или стенкой сосуда S:
Н + Н + М ® Н2 + М
Н + Н + S ® Н2 + S
Cl + Cl + M(S) ® Cl2 + M(S)
Н + Cl + M(S) ® HCl + M(S)
В присутствии, например, кислорода обрыв цепи может происходить в результате реакции
Н + О2 + М ® 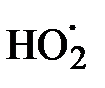 + М
+ М
Образующийся малоактивный радикал 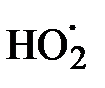 гибнет на стенках сосуда или по реакции
гибнет на стенках сосуда или по реакции
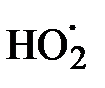 + Н ® Н2 + О2
+ Н ® Н2 + О2
При низких давлениях активные центры гибнут в основном на стенках сосуда, а при высоких давлениях происходит тримолекулярный обрыв в объеме. Поэтому для цепных реакций характерны особенности протекания:
· Большая чувствительность скорости этих реакций к наличию некоторых примесей. Смесь водорода с хлором не реагирует в темноте при комнатной температуре, но быстро реагирует при введении в систему малых количеств паров натрия. В других случаях присутствие примесей приводит к резкому снижению скорости реакции. Например, при фотохимическом инициировании реакции водорода с хлором скорость образования хлороводорода уменьшается примерно в тысячу раз в присутствии одного процента кислорода.
· Влияние формы и материала сосуда на скорость многих газовых реакций. Обычно реакции замедляются при увеличении отношения S / V (S - площадь поверхности сосуда, V - его объем). Это отношение практически можно изменять, вводя в сосуд осколки материала сосуда - стекла, кварца и т.п.
· Резкое увеличение скорости процесса при определенных значениях давления. Первоначально не идущая реакция с повышением давления может принять взрывной характер, но при еще больших давлениях опять прекратиться. Это объясняется тем, что при малых давлениях столкновения между частицами газа редки, а активные частицы, достигая стенок сосуда, поглощаются ими. С другой стороны, при слишком высоких давлениях часто происходят тройные столкновения, также приводящие к прекращению реакции. И лишь только в некотором интервале средних давлений обрывы цепей как на стенках сосуда, так и в объеме смеси малы и в реакцию может вовлечься большое число молекул реагентов (характерно для разветвленных реакций). Давления, при которых происходит резкое увеличение скорости цепных реакций, называются верхним и нижним пределами самовоспламенения или взрываемости. Воспламенение смеси происходит только в условиях, соответствующих на рисунке заштрихованной площади, которая получила название полуострова воспламенения. Вне пределов полуострова воспламенения не происходит и реакция идет с малой скоростью или практически вовсе не происходит.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
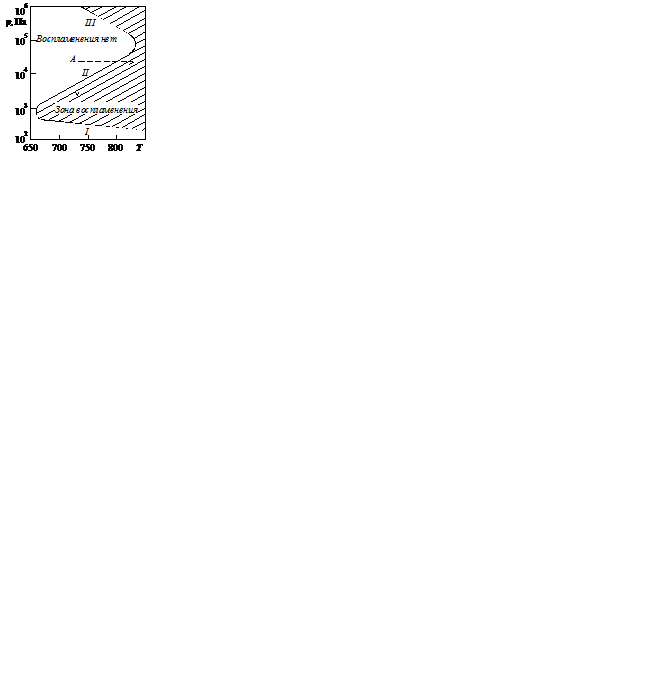 Пределы воспламенения для реакции окисления водорода
Пределы воспламенения для реакции окисления водорода
|
|
|
