
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
C6H5)3C-C(C6H5)3 ® 2(C6H5)3C
|
|
при 00С в смеси толуола и анилина,
| [A, моль/л | 0, 1000 | 0, 0867 | 0, 0733 | 0, 6000 | 0, 0465 | 0, 0334 |
| t, мин | 1, 05 | 2, 20 | 3, 65 | 5, 5 | 7, 85 |
Графическим методом подтвердите первый порядок реакции и определите из графика среднее значение константы скорости при 00С.
2, Реакция кислотного распада p-аллилникельхлорида описывается следующим стехиометрическим уравнением:
p-С3Н5NCl× H2O + HCl = C3H6 + NiCl2 + H2O
Начальные концентрации комплекса и кислоты равны 0, 005 и 0, 010 моль/л, За кинетикой реакции следили по изменению концентрации HCl, Температура 200С. Полученные результаты приведены в таблице:
| Время, мин | |||||||
| [HCl] × 103, моль/л | 5, 00 | 2, 76 | 1, 69 | 1, 10 | 0, 74 | 0, 504 | 0, 349 |
Покажите, что реакция имеет общий второй порядок и найдите среднее значение константы скорости реакции.
3. Реакция термического разложения этана, протекающего при 600ОС
С2Н6 = С2Н4+ Н2
была получена следующая зависимость концентрации этана от времени
| t, мин | ||||||
| СС2Н6, моль/л | 0, 24 | 0, 216 | 0, 194 | 0, 175 | 0, 157 | 0, 141 |
Методом Вант-Гоффа определите порядок реакции и рассчитайте значение константы скорости реакции,
4. Газофазную реакцию 2А®В контролировали по изменению общего давления в зависимости от времени, Были получены следующие данные:
t, с 0 100 200 300 400
Робщ, мм.рт.ст. 400 322 288 268 256
Определите порядок реакции по компоненту А и вычислите значение
константа скорости? За какое время реакция пройдет на 70%?
5. При 518оС время полупревращения реакции разложения бензальдегида при начальном давлении 300 мм.рт.ст. составляет 450 с, а при исходном давлении 200 мм.рт.ст. t1/2 равно 675 с.
Определите порядок реакции и константу скорости реакции.
6. Константа скорости окисления йодистоводородной кислоты пероксидом водорода H2O2 + 2HI = 2H2O + I2 изменяется с температурой следующим образом:
| t, 0С | ||
| k × 102, л/(моль× с) | 4, 32 | 8, 38 |
Вычислите энергию активации и константу скорости реакции при 400С.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ ( при С o=1 моль/л) при температуре 400С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
8. Рассчитайте константу скорости бимолекулярной реакции термического разложения оксида хлора в газовой фазе 2Cl2O à 2Cl2 + O2 при температуре 1110С, используя следующие данные: эффективный диаметр столкновения s = 0, 48 нм; экспериментальное значение энергии активации Еа = 92 кДжмоль и стерический фактор р =1.
9. Смесь кетонной (А) и енольной (В) форм ацетоуксусной кислоты доводят до равновесия, измеряя изменение показателя преломления во времени, по которому определяют содержание енольной формы В.

 Н3С− С(ОН)=СН− СООН Н3С− СО− СН2− СООН
Н3С− С(ОН)=СН− СООН Н3С− СО− СН2− СООН
(А) (В)
| τ, мин | 4, 25 | 6, 50 | 9, 17 | 12, 0 | 14, 2 | 20, 8 | 24, 2 | 27, 5 | 31, 5 | ∞ | |
| В, % | 76, 3 | 72, 5 |
Определите константы скоростей прямой и обратной реакций первого порядка и константу равновесия.
10. Фотохимическая реакция разложения C2H4I2 протекает по схеме:
I2 à 2I·
I· + C2H4I2 à I2 +C2H4I·
C2H4I· à C2H4 + I·
2 I· + M à I2 +M
Используя метод квазистационарного приближения по I· и C2H4I·, выведите кинетическое уравнение для разложения C2H4I2 и найдите, чему равен порядок реакции и эффективная константа скорости.
11. Для реакции гидрирования олефина с использованием родиевого катализатора RhH(CO)(PPH3)2 предложена схема реакции:

 RhH(CO)(PPH3)2 + алкен Rh(алкил)(CO)(PPH3)2 (k1, k-1)
RhH(CO)(PPH3)2 + алкен Rh(алкил)(CO)(PPH3)2 (k1, k-1)
 Rh(алкил)(CO)(PPH3)2 + H2 RhH(CO)(PPH3)2 + алкан (k2)
Rh(алкил)(CO)(PPH3)2 + H2 RhH(CO)(PPH3)2 + алкан (k2)
Используя метод квазистационарных концентраций по Rh(алкил)(CO)(PPH3)2 выведите уравнение для скорости образования продукта алкана.
Определите порядок реакции по H2 при очень высокой концентрации водорода.
12.
Вариант 20.
1. В реакции окисления метана CH4 + 2O2 = CO2 + H2O, протекающей с постоянной скоростью, в течение 5 мин, в сосуде объемом 0, 5 л при 500оС образуется 5, 10-4 моль воды. Рассчитайте скорость реакции в Па/мин cчитая, что в начальный момент концентрация воды равна нулю.
2. За кинетикой декарбоксилирования гидробензойной кислоты
C6H7CООН® C6H8 + CО2
следили по количеству выделившегося диоксида углерода за равные интервалы времени:
| t, с | ¥ | |||||||
| VCО2, см3 | 5, 9 | 10, 0 | 14, 0 | 17, 2 | 19, 8 | 21, 9 | 23, 7 | 32, 1 |
Определите общий объем выделившегося оксида углерода и константу скорости 1-го порядка,
Обратите внимание, что t = ¥ весь C6H7CООН превратится в CО2 , следовательно Со (C6H7CООН) ~ V ¥ CО2
Определите константу скорости реакции первого порядка,
3. Константа скорости второго порядка для щелочного гидролиза этилформиата при 29, 86оС равна 4, 53 л/моль, с. Найдите время полупревращения, если оба реагента имеют одинаковую концентрацию 0, 001моль/л. Если концентрацию одного из реагентов удвоить, а другого уменьшить в два раза, то через какое время прореагирует половина вещества с меньшей концентрацией?
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
НСООС2Н5 + NаОН à НСООNа + С2Н5ОН
4. Изменение концентрации метильных радикалов 2СН3· à С2Н6
изучали с помощью флеш-фотолиза (мгновенных вспышек). Были получены
следующие данные:
| Время, мкс | ||||||
| [CH3∙ ]*106, М | 1, 25 | 0, 95 | 0, 80 | 0, 65 | 0, 57 | 0, 50 |
Методом Вант-Гоффа определите порядок реакции и рассчитайте значение константы скорости реакции.
5. По мере течения реакции между эквивалентными количествами окиси углерода и хлора, согласно уравнению СО + Сl2 = СОСl2 при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
| t, мин | |||||
| Робщ, мм.рт.ст. |
Определите порядок реакции (V=const) графическим и аналитическим методом и константу скорости.
6. Каково время полураспада гидрида кремния SiH4 при 700К по уравнению
SiH4 à Si + 2 H2,
если константа скорости первого порядка для этой реакции описывается уравнением k = 2× 1013* exp (- 216300/RT). Размерность энергии активации E Дж/моль.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ ( при С o=1 моль/л и С o=1 моль/см3) при температуре 7000С.Сделайте вывод о типе реакции (“нормальная”, “медленная” или “быстрая”)?
8. Для бимолекулярной газовой реакции О2 + СО à CО2 + О получены экспериментальные значения констант скоростей k = 1, 22*105 л/моль, с при 2500К и k = 3, 66*105 л/моль, с при 2800К. Найдите экспериментальные значения энергии активации и предъэкспоненциальный множитель Аэксп.. Полагая, что эффективные диаметры молекул О2 и СО соответственно равны s = 0, 35 нм с помощью теории ТАС найдите Aтеор и значение стерического фактора р.
9. Реакция превращения g -оксимасляной кислоты в лактон (Х) представляет собой обратимую реакцию первого порядка как в прямом, так и в обратном направлениях (концентрация воды постоянная):

(х)
Начальная концентрация g-оксимасляной кислоты была равна 0, 1823 моль/л. Ниже приведены данные изменения концентрации лактона во времени:
| t, мин | ¥ | ||||||
| х • 102, М | 2, 41 | 3, 73 | 4, 99 | 6, 10 | 7, 08 | 8, 11 | 13, 28 |
Рассчитайте константу равновесия данной реакции и значения констант скоростей прямой и обратной реакций.
10. Для следующей схемы сложной реакции:
k1
A +В = X +C
k-1
k2
X +В → Пр +А
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинети-
ческое уравнение реакции по реагенту В.
11. Для реакции разложения аминонитрита, протекающей в водном растворе,
NH2NO2 → H2O +N2O (г)
предложен следующий механизм:

 NH2NO2 + H2O -NHNO2 + H3O+ (k1, k-1)
NH2NO2 + H2O -NHNO2 + H3O+ (k1, k-1)
 − NHNO2 OH− +N2O (k2)
− NHNO2 OH− +N2O (k2)

 OH− + H3O+ 2H2O (k3 , k-3)
OH− + H3O+ 2H2O (k3 , k-3)
Используя МКСК по аниону -NHNO2 получите выражение для скорости реакции
образования N2O.
12.
Вариант 21.
1. При смешении 1 л 0, 05 М раствора NaOH и 1 л 0, 05 М раствора этилацетата эфир омыляется на 50% в течение 16, 8 мин.
СН3СО2C2H5 + NaOH = СН3СООNa + C2H5OH
Реакция имеет первый порядок по каждому из реагентов, Определите константу скорости.
2. Скорость окисления бутилового спирта xлорноватистой кислотой
С4Н9ОН + HClO = C3H7CHO + HCl + H2O
не зависит от концентрации спирта и пропорциональна концентрации НСlО во второй степени, Вычислите время, в течение которого прореагирует 90% НСlО в растворе, содержащем 0, 1 моль/л НСlО при 298, 2 К. Константа скорости реакции при этой температуре равна 24 л/(моль·мин), Запишите выражение для скорости реакции.
3. Разложение пероксида водорода в водном растворе протекает по уравнению Н2О2 = Н2О + О. Кинетика реакции исследовалась путем титрования проб одинакового объема (2 см3) марганцовокислым перманганатом калия (0, 0015 N раствор) на содержание Н2О2: VKMnO4*N KMnO4 = VН2О2*N Н2О2. Определите порядок реакции и рассчитайте среднее значение константы скорости этой реакции, пользуясь следующими данными:
| t, мин | |||||||
| VKMnO4, мл | 23, 6 | 18, 1 | 14, 8 | 12, 1 | 9, 4 | 5, 8 | 3, 7 |
4. Реакция разложения аммиака на горячей вольфрамовой проволоке протекает по следующему стехиометрическому уравнению:
NН3 = 1/2 N2 + 3/2 Н2
За реакцией следили по изменению общего давления. В различные моменты времени давление увеличивалось следующим образом:
| t, с | ||||||
| DР, мм. рт. ст. | 11, 0 | 22, 1 | 44, 0 | 66, 3 | 87, 9 |
(где DР=Робщ, -Р0). При условии, что начальное давление равнялось 200 мм рт, ст, графически методом подбора определите порядок реакции и рассчитайте константу скорости.
5. Изучалась зависимость скорости распада диоксида азота от концентрации реагента
2NO2 = 2NO +O2
Определите вид кинетического уравнения этой реакции и рассчитайте значение константы скорости по следующим данным:
| С*105NO2, моль/л | 4, 47 | 5, 01 | 6, 31 | 7, 94 | 12, 59 | |
| r, моль/(л, сек) | 0, 032 | 0, 040 | 0, 063 | 0, 095 | 0, 158 | 0, 214 |
6. Константа скорости реакции разложения ацетондикарбоновой кислоты
O=C(CH2COOH)2 ® O=C(CH3)2 +2CO2
при Т1 = 273, 2 К равна k1 = 2, 46× 10-5 мин-1
при Т2 = 313, 2 К равна k2 = 5, 76× 10-3 мин-1.
Вычислите время, в течение которого реакция пройдет на 70% при Т = 323, 2 К.
7. По данным предыдущей задачи 6 рассчитайте DНº ¹ , DSсº ¹ ( при С o=1 моль/л) при температуре 350 К.Сделайте вывод о типе реакции (быстрая, нормальная, медленная).
8. Вычислите константу скорости бимолекулярной реакции образования хлорэтана:
HCl + C2H4 à C2H5Cl
При температуре 700К, используя следующие данные: значения эффективных диаметров s для молекул HCl (0, 334 нм) и этилена (0, 357 нм), опытной энергии активации, Еа = 176 кДж/моль и стерического множителя р =2, 8*10-3 .
9. В газовой фазе протекает реакция: А à B à C
Для опыта были взяты 1моль газа А. Константы скорости отдельных стадий реакции соответственно равны: k1 = 18 • 10-2 с-1 и k2 = 2*10-2 с-1. Рассчитайте время достижения максимальной концентрации вещества В. Какова будет концентрация веществ А и С к этому моменту времени?
10. Для реакции замещения бромистого алкила RBr + OH- ð ROH + Br- предложен следующий механизм:
RBr ð R+ + Br- k1
R+ + Br- ð RBr k-1
OH- + R+ ð ROH k2
Используя МКСК по R+ получите выражение для скорости образования ROH.
11. Химическая реакция N2O à N2 + 1/2O2 протекает по следующему механизму
(М — инертная частица):
N2O +M à N2O· +M k1
N2O· à N2 + O· k2
N2O· +M à N2O + M k3
N2O + O· à N2 + O2 k4
Используя метод квазистационарного приближения по N2O· и O·, найдите выражение для скорости реакции.
12.
Вариант 22.
1. Превращение пероксида бензоила в дифениловый эфир
(С6Н5СОО)2 = С6Н5СОО С6Н5 + СО2
(реакция первого порядка) при температуре 60oС прошла за 10 мин на 75%. Вычислить константу скорости реакции.
2. Диазобензолхлорид в водном растворе разлагается по уравнению:
C6H5N2+Cl- ® C6H5Cl + N2
За реакцией удобно следить по количеству выделяющегося N2 при 130С и давлении, равном 750 мм.рт.ст. В реакцию взято 35 см3 раствора, содержащего 10 г/л диазобензолхлорида. Были получены следующие результаты:
| t, мин | ¥ | |||||
VN 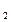 , см3 , см3
| 9, 7 | 16, 2 | 26, 3 | 33, 7 | 54, 3 | 60, 0 |
Обратите внимание, что t = ¥ весь диазобензолхлорид превратится в N2 , следовательно Со (C6H5N2+Cl-) ~ V ¥ N 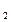
Определите порядок реакции и рассчитайте константу скорости реакции и время полупревращения.
3. Реакция разложения аммиака на горячей вольфрамовой проволоке протекает по следующему стехиометрическому уравнению:
NН3 = 1/2 N2 + 3/2 Н2
За реакцией следили по изменению общего давления. В различные моменты времени давление увеличивалось следующим образом:
| t, с | ||||||
| Робщ, мм.рт.ст. | 211, 0 | 222, 1 | 244, 0 | 266, 3 | 287, 9 |
При условии, что начальное давление равнялось 200 мм.рт.ст, графически методом подбора определите порядок реакции и рассчитайте константу скорости.
4. Время полупревращения вещества А равно 10 годам (реакция протекает по закону первого порядка). В сосуд объемом 0, 2 л введено некоторое количество этого вещества, Измерение его концентрации, проведенные через 30 и 35 мин после начала опыта, показали, что за время между двумя замерами распалось 2, 1010 частиц. Чему равна начальная концентрация вещества А?
5. В таблице приведены данные по кинетике разложения гексафенилэтана (А):
|
|
