
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решения кинетических уравнений некоторых простых и сложных реакций
|
|
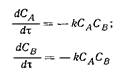
| Механизм реакции | Кинетическое уравнение | Решение | Константа скорости |

| 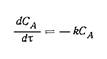
| 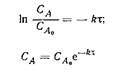
| 
|

| 
| 
| 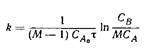
|

| 
| 
| 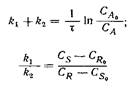
|

| 
| 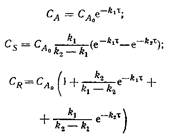
| 
|

| 
| 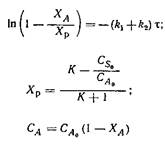
| 
|
Необходимость решения дифференциальных кинетических уравнений или их систем возникает чаще всего в одной из следующих задач:
1. Известна схема реакции и величины констант скорости отдельных стадий. Требуется рассчитать концентрацию того или иного компонента в некоторый момент времени или установить время, за которое концентрация того или иного компонента достигает определенного значения. Для этого достаточно найти уравнение кинетической кривой по интересующему исследователя продукту.
2. Известна схема процесса и опытным путем найдены кинетические кривые компонентов реакции. Необходимо определить константы скорости отдельных элементарных стадий. В этой задаче надо решить дифференциальное уравнение (или систему) в общем виде с константами скорости в качестве параметров, а затем подобрать такие значения параметров, которые приводят к совпадению решений с найденными опытным путем кинетическими кривыми.
3. Схема процесса носит гипотетический характер. Требуется установить соотношения между кинетическими характеристиками системы (скоростями, текущими концентрациями, временем), позволяющие проверить правильность предложенной схемы. Гипотетические соотношения выбирают в общем виде с константами скорости в качестве параметров и подставляют в них экспериментальные данные. Если при этом соотношение не оправдывается — схему отвергают, как не соответствующую опытным данным, если же соотношение оправдывается, то это является более или менее веским доводом в пользу правильности выбранной схемы.
При решении каждой из перечисленных задач следует сочетать теоретические методы исследований и опытные данные. Третья задача, которая чаще всего возникает при проектировании нового технологического процесса, наиболее трудоемкая и требует использования вычислительных машин. Решение такой задачи является необходимой предпосылкой для составления математического описания кинетики проектируемого процесса и построения математической модели реактора.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Особенности гетерогенных процессов
Во всяком гетерогенном процессе взаимодействие между компонентами происходит на поверхности раздела фаз или в непосредственной близости от нее. Гетерогенными системами могут быть: жидкость (газ) – твердое тело; жидкость (газ) – жидкость и др.
Различают некаталитические гетерогенные процессы и каталитические. К числу некаталитических относятся гетерогенные процессы, протекающие как в системе из одного компонента (плавление, кристаллизация, испарение, конденсация, возгонка), так и в системах из двух и более компонентов (растворение, ректификация, дистилляция и т. п.). Скорость таких процессов зависит от величины и состояния поверхности раздела фаз (помимо факторов, характеризующих каждый конкретный процесс). Скорость возрастает при увеличении поверхности и при непрерывном ее обновлении, которое обеспечивается за счет движения.
В гетерогенных каталитических процессах принимает участие катализатор, который, как правило, составляет самостоятельную фазу и оказывает сильное влияние на скорость реакции. Скорость гетерогенных каталитических реакций обычно относят к единице поверхности раздела фаз:

Во всех процессах гетерогенного катализа реакция протекает на поверхности самого катализатора.
Гетерогенный катализ широко применяется в промышленной практике, при этом наиболее часто встречаются гетерогенные каталитические системы, в которых взаимодействие компонентов происходит на поверхности раздела твердой и газообразной (или жидкой) фаз. Твердой фазой, обычно, является катализатор. Имеются, конечно, и такие химические процессы, которые протекают либо на поверхности раздела жидкой и газообразной фаз (например, гидрогенизация жидких нефтепродуктов, сатурация, или очистка диффузионного сахарного сока с помощью углекислого газа), либо на поверхности двух жидких фаз (например, нитрование бензола или толуола).
Однако большинство промышленных каталитических процессов осуществляется в гетерогенных системах твердое тело – газ (так называемые газовые каталитические реакции). К числу таких процессов относятся:
синтез аммиака, метанола, винилацетата, высших спиртов;
окисление двуокиси серы, этилена, метанола, нафталина;
конверсия метана, окиси углерода и прочее.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
На ход гетерогенных каталитических процессов существенно влияют размеры и природа поверхности твердой фазы; характер потока газа (жидкости) у поверхности твердого тела (ламинарный или турбулентный режим); процессы диффузии веществ, которые обусловливают движение реагирующих компонентов к твердой поверхности и отвод от нее продуктов реакции в газообразную (жидкую) фазу, так называемое транспортирование веществ.
Для гетерогенных систем других типов в целом картина аналогична, и кинетика гетерогенного каталитического процесса определяется не только скоростью химического превращения, но и скоростью диффузии, которая зависит от типа гетерогенной системы. Следовательно, характерной особенностью гетерогенных химических процессов является усложнение их явлениями диффузии и в связи с этим в общем случае математическое описание скорости, кроме обычных кинетических уравнений гомогенных реакций, должно содержать еще и выражение массопередачи. Трудность состоит в том, что не может быть одного универсального уравнения скорости, так как выражение массопередачи зависит от типа гетерогенной системы.
На скорость гетерогенного процесса влияет также гидродинамическая структура потока или комбинация контактирующих потоков. Каждому способу контактирования двух фаз отвечает специфическая форма расчетного уравнения и, следовательно, методы расчета гетерогенных систем каждого типа обладают своими характерными особенностями.
Общим для всех гетерогенных систем является то, что кинетическое уравнение описывает результирующую (суммарную) скорость гетерогенного процесса, включающую скорость химического превращения и скорость диффузии. Составляющие суммарной скорости могут иметь близкие значения или резко отличаться друг от друга.
В зависимости от соотношения между скоростью химического превращения и скоростью диффузии химические процессы в гетерогенных системах могут протекать, либо в кинетической, либо в диффузионной, либо в смешанной области.
Химические процессы, протекающие в кинетической области, характеризуются тем, что скорость собственно химической реакции является наиболее медленной и лимитирует весь процесс, а скорость движения потоков и их физические свойства на процесс не оказывают заметного влияния. Для расчета таких процессов могут быть использованы кинетические зависимости без учета влияния диффузии, так как кинетика в целом определяется скоростью химического превращения. Условия для возникновения кинетической области создаются при низких температурах, низких давлениях и больших скоростях газового потока.
Для химических процессов, протекающих в диффузионной области, скорость диффузии реагентов к зоне реакций является лимитирующей и зависит от скорости движения потоков и их физических свойств. Чтобы рассчитать такие процессы, следует пользоваться зависимостями, характеризующими диффузию, так как кинетика реакции в целом обусловливается скоростью диффузии. В диффузионной области скорость процесса сравнительно мало зависит от температуры и практически не зависит от конкретных особенностей химического механизма реакции. Скорости отдельных реакций отличаются лишь постольку, поскольку коэффициенты диффузии реагирующих веществ различны. Все реакции в диффузионной области имеют первый порядок по концентрации реагирующего вещества при постоянном общем давлении. Условия для возникновения диффузионной области создаются при высоких температурах, высоких давлениях и малых скоростях газового потока.
Химические процессы в смешанной области протекают при соизмеримых скоростях химического превращения и диффузии. Здесь уже существенно и одновременное влияние диффузии и кинетики химического превращения, т.е. необходимо находить суммарную скорость процесса. При этом механизм и уравнения скорости гетерогенных каталитических реакций можно выражать через давления компонентов реакционной смеси и для описания скорости процесса использовать концепцию адсорбции и десорбции реагентов и продукта реакции на активных центрах. Подбор уравнений кинетики может производиться несколькими способами, в том числе и при помощи вычислительных машин.
Из изложенного выше следует, что понятие лимитирующей стадии как стадии, определяющей скорость процесса в целом, имеет важное значение и поэтому исследование кинетики гетерогенных систем обычно начинают с установления лимитирующей стадии процесса. Наиболее просто ее распознают по температурному коэффициенту суммарной скорости процесса. Сущность указанного метода состоит в экспериментальном определении суммарной скорости процесса при различных температурах.
Если с изменением температуры на 10°С суммарная скорость процесса изменяется в 2÷ 4 раза, то, как следует из уравнения Аррениуса, лимитирующей стадией является собственно химическое превращение (кинетическая область). Если же с изменением температуры на 10°С скорость процесса изменяется меньше, чем в 1, 8 раза, то лимитирующим будет массообмен (диффузионная область). В промежуточных случаях реакция протекает в смешанной (диффузионно-кинетической) области.
Другие методы определения лимитирующей стадии описаны, например, в книгах «Методы кибернетики в химии и химической технологии» - Кафаров В.В.; «Введение в инженерные расчеты реакторов с неподвижным слоем катализатора» - Кафаров В.В. и Михайлов Г.В.
При исследованиях гетерогенных процессов необходимо установить также природу транспортных явлений (перенос вещества и тепла), которые неодинаковы для разных типов гетерогенных систем.
В качестве примера приведем гипотезу о влиянии переноса в случае гетерогенной системы твердое тело – газ, в соответствии с которой выделяются такие стадии (см. рис. 8.4):
1) теплообмен и массообмен между внутренней областью частицы твердой фазы (катализатора) и ее поверхностью;
2) теплообмен и массообмен между наружной поверхностью частицы катализатора и потоком газа;
3) перенос тепла и вещества по слою твердой фазы;
4) теплопередача через наружную стенку.

Рис. 8.4. Тепло- и массоперенос в неподвижном слое катализатора (система газ – твердое тело).
Механизм процессов, протекающих в гетерогенных системах, отличается сложностью и еще недостаточно изучен, несмотря на существование многих теорий. Первые теоретические работы по химической адсорбции на поверхности твердого тела принадлежат Ленгмюру. Однако расчеты по уравнению Ленгмюра во многих случаях не согласуются с опытными данными, вследствие принятых при его выводе допущений, которые ощутимо искажают реальный процесс.
В настоящее время в разработано несколько теорий гетерогенного катализа:
ü теория промежуточных соединений — химическая теория катализа;
ü адсорбционная теория — физическая теория катализа;
ü теория поверхностных промежуточных соединений (Г. К. Боресков, М. И. Темкин, Н. И. Кобозев);
ü мультиплетная теория (Н. Д. Зелинский, А. А. Баландин);
ü теория активных ансамблей (Н. И. Кобозев);
ü электронные теории (Л. В. Писаржевский, С. 3. Рогинский, Ф. Ф., Волькенштейн);
ü цепные теории (Н. Н. Семенов, В. В. Воеводский).
Эти теории все же не являются универсальными, так как каждая из них удовлетворительно объясняет какую-либо сторону сложного процесса катализа, а не весь процесс в целом.
Предпосылки, используемые различными авторами для определения кинетических уравнений гетерогенно-каталитических реакций, значительно отличаются, и до настоящего времени нет единого мнения о пригодности тех или других кинетических моделей.
В инженерных расчетах реакторов с неподвижным слоем катализатора практический интерес имеют кинетические уравнения, основанные на представлениях Ленгмюра - Хиншельвуда, кинетические уравнения Хоугена - Ватсона, степенная кинетическая модель. Анализ указанных моделей и таблица кинетических уравнений для различных реакций с учетом вида катализатора приведены в книге Кафарова В.В. и Михайлова Г.В. «Введение в инженерные расчеты реакторов с неподвижным слоем катализатора».
Построение кинетических моделей
Как уже отмечалось ранее, уравнения кинетики процесса (кинетическая модель) являются основой математического описания химического реактора и от точности, с которой они отражают кинетику химического процесса, зависит точность всего последующего расчета реактора и адекватность математической модели. В связи с этим проблеме кинетических моделей химических процессов в советской и зарубежной литературе уделяется значительное внимание (работы В. В. Кафарова, М. Г. Слинько, И. И. Иоффе и Л. М. Письмена, В. В. Налимова и Н. А. Черновой, Р. Ариса, С. Вэйласа, О. Левеншпиля и др.).
Для простых реакций установление кинетических уравнений и расчет констант этих уравнений не представляют особых затруднений. При сложных реакциях и, соответственно, сложных уравнениях с большим числом коэффициентов расчет становится трудоемким, а нередко и невозможным без применения компьютеров.
Обычная процедура составления кинетической модели может быть изображена следующей схемой (рис. 8.5).
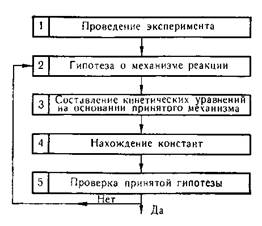
Рис. 8.5. Схема построения кинетической модели
На первом этапе собирают информацию о процессе в ходе опытных исследований (например, фиксируют изменение концентрации исходного вещества во времени), а также анализируют имеющиеся теоретические обобщения. На втором этапе последовательно строят гипотезы о вероятном механизме реакции, исходя из теоретических и экспериментальных сведений о процессе. На третьем и четвертом этапах составляют кинетические уравнения, описывающие выбранный механизм реакции, и каким-либо способом определяют значения констант скоростей реакций, которые являются коэффициентами указанных уравнений. Затем по уравнениям находят расчетные кинетические кривые или вычисляют значения кинетических характеристик, соответствующих условиям, при которых проводились эксперименты на первом этапе.
Содержанием пятого заключительного этапа является проверка принятой гипотезы о механизме реакции. С этой целью сравнивают расчетные и экспериментальные данные, полученные на четвертом и первом этапах для одних и тех же условий. Если результаты сравнения неудовлетворительные, т. е. расхождения между расчетными и экспериментальными данными недопустимо велики, то следует возвратиться ко второму этапу (выбрать новую гипотезу) и повторять решение задачи до тех пор, пока не будет достигнуто совпадение, удовлетворяющее требованиям данного исследования. Выбор удачной гипотезы зависит как от количества и качества теоретической и экспериментальной информации, так и от опыта исследователя.
Наиболее сложным является четвертый этап, поскольку при определении константы скорости реакции нередко возникают существенные трудности. В настоящее время известны различные методы установления этого важного параметра, основанные на сочетании эксперимента и теории, которые применяются для нахождения констант скоростей реакций соответствующего типа. В результате проведения экспериментальных исследований и использования соответствующих методов уже сейчас известны достаточно надежные значения констант скоростей для различных химических реакций. Однако еще многие реакции характеризуются малонадежными константами, требующими для их уточнения постановки новых измерений, или же вовсе не имеют количественных характеристик.
Например, в книге В. Н. Кондратьева «Определение констант скорости газофазных реакций» приведены данные о константах скоростей газофазных реакций, кратко изложена сущность применяемых в современной кинетике основных экспериментальных методов определения констант скорости элементарных химических процессов и дана критическая оценка результатам исследований отечественных и зарубежных ученых в этой области. В числе современных методов в указанной книге рассмотрено также применение вычислительной техники, для определения вероятных значений констант скорости реакций и приведены соотношения, найденные при помощи ЭВМ, по которым вычисляются вполне надежные значения констант.
Отметим, что моделирование химической кинетики на ЭВМ и постановка математического эксперимента позволяют выяснить максимальное количество информации о процессе. При этом можно установить, во-первых, варианты механизмов реакций, которые согласуются с результатами экспериментального исследования процесса и, во-вторых, значения параметров, описывающих данный механизм реакции.
Задача определения кинетических констант сложной реакции обычно формулируется как задача поиска минимума функции многих переменных (предэкспонент, энергий активации и др.). Подобную экстремальную задачу можно решать различными способами. Опыт показывает, что эффективными при этом являются методы нелинейного программирования. Большой объем вычислений и нелинейность функций при решении таких задач требуют применения для разработки кинетических уравнений (этапы 4 и 5) компьютеров и современного программного обеспечения.
Задания для самостоятельного решения
1. Как взаимосвязаны между собой реальные скорости образования и расходования отдельных участников реакции
aA + bB → rR + sS?
2. Что такое частный порядок реакции по компоненту Ai? Как взаимосвязаны частные порядки по разным компонентам и общий порядок реакции?
3. Запишите уравнение Аррениуса в дифференциальной, интегральной и логарифмической формах. В чем суть уравнения С. Аррениуса?
4. Определите энергию активации реакции, если при изменении температуры от 450 до 500°С ее скорость возрастает в 2, 73 раза.
5. Две параллельные реакции
a1A + b1B → rR + sS (целевая реакция)
a2A + b2B → yY + zZ (побочная реакция)
характеризуются следующими кинетическими уравнениями:

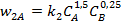
Энергии активации реакций равны Е1 = 45 кДж/моль, Е2 = 65 кДж/моль, соответственно. Проанализируйте зависимость дифференциальной селективности для такой системы реакций: а) от концентрации реагента А; б) от концентрации реагента В; в) от температуры. Какие можно дать рекомендации по выбору технологического режима для этого процесса на основе проведенного анализа?
|
|
